相同温度下,体积均为0.25 L的两个恒容容器中发生可逆反应:
X2(g)+3Y2(g) 2XY3(g) ΔH=-92.6 kJ·mol-1,实验测得反应在起始、达到平衡时的有关数据如下表所示:
2XY3(g) ΔH=-92.6 kJ·mol-1,实验测得反应在起始、达到平衡时的有关数据如下表所示:
| 容器 编号 |
起始时各物质物质的量/mol |
达平衡时体系 能量的变化 |
||
| X2 |
Y2 |
XY3 |
||
| ① |
1 |
3 |
0 |
放热46.3 kJ |
| ② |
0.8 |
2.4 |
0.4 |
Q(Q>0) |
下列叙述不正确的是
A.容器①、②中反应平衡时XY3的平衡浓度相同
B.容器①、②中达到平衡时各物质的百分含量相同
C.达平衡时,两个容器中XY3的物质的量浓度均为2 mol·L-1
D.若容器①体积为0.20 L,则达平衡时放出的热量大于46.3 kJ
根据下表(部分短周期元素的原子半径及主要化合价)信息,判断以下叙述正确的是()
| 元素代号 |
A |
B |
C |
D |
E |
| 原子半径/nm |
0.186 |
0.143 |
0.089 |
0.104 |
0.074 |
| 主要化合价 |
+1 |
+3 |
+2 |
+6、-2 |
-2 |
| A.C2+与B3+的核外电子数不相等 |
| B.单质与稀盐酸反应的速率A<B |
| C.最高价氧化物对应水化物的碱性A<C |
| D.氢化物的稳定性H2D<H2E |
瘦肉精结构简式如右图。溶于水、乙醇,微溶于丙酮,不溶于乙醚。对于瘦肉精的说法正确的是()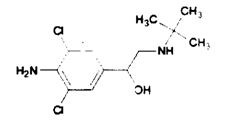
| A.瘦肉精的化学式:C12H18N2Cl2O |
| B.瘦肉精是高分子化合物 |
| C.能用乙醚等有机溶剂将瘦肉精从水溶液中萃取出来 |
| D.瘦肉精属于芳香烃 |
某种氢氧燃料电池的电解液为KOH溶液。下列有关电池的叙述不正确的是()
| A.正极反应式为:O2+2H2O+4e- |
| B.工作一段时间后,电解液中的KOH的物质的量不变 |
| C.该燃料电池的总反应方程式为:2H2+O2 |
| D.放电过程中,溶液中K+向负极移动 |
下列反应的离子方程式书写正确的是()
| A.含1molFeCl2的溶液中通入1molCl2 Fe2++Cl2=Fe3++2Cl- |
| B.NaClO溶液中通入过量的SO2气体 ClO-+SO2+H2O |
| C.在足量热的稀硫酸中不断通入空气氧化废铜 2Cu+O2+4H+=2Cu2++2H2O |
| D.工业上将硫酸工业尾气SO2持续通入氨水中 SO2+OH-=HSO3一 |
下列有关气体制备的实验,其中装置和药品选用不正确的是()