为了保护环境,充分利用资源,某研究小组通过如图简化流程,将工业制硫酸的硫铁矿烧渣(含Fe2O3.SiO2.Al2O3等)转变成重要的工业原料FeSO4(反应条件略)

活化硫铁矿还原Fe3+的主要反应为:FeS2+7Fe2(SO4)3+8H2O═15FeSO4+8H2SO4,不考虑其它反应,请回答下列问题:
(1)第1步H2SO4与Fe2O3反应的离子方程式是_____ _____.
(2)检验第II步中Fe3+是否完全还原,应选择__________(填字母编号).
| A.KMnO4溶液 | B.KSCN溶液 | C.KCl溶液 | D.KOH |
(3)第III步加FeCO3调溶液pH=6时,利用相关数据计算,(已知Ksp Al(OH)3=1.9×10﹣33,当离子浓度小于1×10﹣5mol•L﹣1时,可认为沉淀完全)判断Al3+_______(填“是”或“否”)能沉淀完全。
(4)FeCO3在空气中加热反应可制得铁系氧化物材料.
已知25℃,101kPa时:4Fe(s)+3O2(g)═2Fe2O3(s)△H=﹣1648kJ/mol
C(s)+O2(g)═CO2(g)△H=﹣393kJ/mol
2Fe(s)+2C(s)+3O2(g)═2FeCO3(s)△H=﹣1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是__________.
(5)FeSO4溶液在加热浓缩结晶时要注意_________________________________,FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料,该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+FeS2═Fe+2Li2S,正极反应式是__________.
(14分,每空2分)某研究性学习小组设计一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用下图装置完成了O元素的非金属性比S强的实验研究。回答下列问题: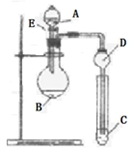
(1)图中D装置在实验中的作用是_______________。
(2)从以下所给物质中选出甲同学设计的实验所用到物质,图中试剂A为_________
①HNO3溶液②稀盐酸③稀醋酸④稀盐酸
写出试管C中发生反应的离子方程式 ______________________________________。
(3)乙同学设计的实验所用到试剂A为_________;试剂B为_________;试剂C为__________。
C处的现象为浅黄色沉淀产生;写出C中发生反应的化学方程式为___________。
某学习小组探究溴乙烷的消去反应并验证产物。
实验原理:CH3CH2Br + NaOH 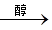 CH2=CH2↑ + NaBr + H2O
CH2=CH2↑ + NaBr + H2O
实验过程:组装如图所示装置,检查装置气密性,向烧瓶中注入10mL溴乙烷和 15mL饱和氢氧化钠乙醇溶液,微热,观察实验现象。一段时间后,观察到酸性KMnO4溶液颜色褪去。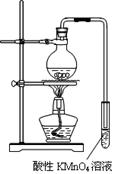
(1)甲同学认为酸性KMnO4溶液颜色褪去说明溴乙烷发生了消去反应,生成了乙烯;而乙同学却认为甲同学的说法不严谨,请说明原因:。
(2)丙同学认为只要对实验装置进行适当改进,就可避免对乙烯气体检验的干扰,改进方法为:。
改进实验装置后,再次进行实验,却又发现小试管中溶液颜色褪色不明显。该小组再次查阅资料,对实验进行进一步的改进。
资料一:溴乙烷于55℃时,在饱和氢氧化钠的乙醇溶液中发生取代反应的产物的百分比为99%,而消去反应产物仅为1%。
资料二:溴乙烷发生消去反应比较适宜的反应温度为90℃~110℃,在该范围,温度越高,产生乙烯的速率越快。
资料三:溴乙烷的沸点:38.2℃。
(3)结合资料一、二可知,丙同学改进实验装置后,溶液颜色褪色不明显的原因可能是,此时发生反应的化学方程式为: 。
(4)结合资料二、三,有同学认为应将实验装置中烧瓶改成三颈烧瓶并增加两种仪器,
这两种仪器是①。② 。
通常用燃烧的方法测定有机物的分子式,可在燃烧室内将有机物样品与纯氧在电炉加热下充分燃烧,根据产品的的质量确定有机物的组成。下图所示的是用燃烧法确定有机物分子式的常用装置。
现准确称取4.4 g样品(只含C、H、O三种元素中的两种或三种),经燃烧后A管增重8.8 g,B管增重3.6g。请回答:
(1)C管中浓硫酸的作用是________________________________________;
(2)按上述所给的测量信息,装置的连接顺序应是:_______________(每种装置只用一次);
(3)要确定该有机物的分子式,还必须知道的数据是_________________;
①C装置增加的质量
②样品的摩尔质量
③CuO固体减少的质量
(4)相同条件下,若该有机物蒸气对氢气的相对分子质量为22,且它的核磁共振氢谱上有两个峰,其强度比为3:1,试通过计算确定该有机物的结构简式,与该有机物相对分子质量相同的烃的一氯代物有种。
某化学小组采用类似制乙酸乙酯的装置(如图1),以环己醇制备环己烯
已知:
| 密度(g/cm3) |
熔点(℃) |
沸点(℃) |
溶解性 |
|
| 环己醇 |
0.96 |
25 |
61 |
能溶于水 |
| 环己烯 |
0.81 |
-103 |
83 |
难溶于水 |

(1)制备粗品:将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
①A中碎瓷片的作用是 ,导管B除了导气外还具有的作用是 .
②试管C置于冰水浴中的目的是 .
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在______层(填上或下),分液后用______(填入编号)洗涤.
a.KMnO4溶液b.稀H2SO4c.Na2CO3溶液
②再将环己烯按图2所示装置蒸馏,冷却水从______口进入。蒸馏时要加入生石灰,目的是 .
③收集产品时,控制的温度应在____左右,实验制得的环己烯精品质量低于理论产量,可能的原因是____
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是______.
a.用酸性高锰酸钾溶液 b.用金属钠c.测定沸点.
实验室用浓盐酸和MnO2制取并探究Cl2化学性质,装置图下图所示: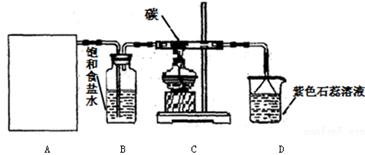
(1)A是氯气发生装置,实验室制取Cl2的原理是(用化学方程式表示)
(2)该实验中A部分的装置是(填字母)
(3)从C装置出来的气体中含有CO2和HCl,则从B装置导出的气体成分是。
(4)D装置的作用是,可能观察到的现象是。
(5)为进行有关氯气的性质实验,需要4瓶容积为122 mL的氯气(室温下,氯气的密度为2.91g/L),理论上需要MnO2的质量是,实际称量的MnO2固体的质量必须适当多余理论量,原因是
(6)若将装置A如图所示进行连接,探究其与某些溶液分反应的性质,回答下列问题。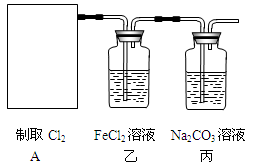
①乙装置中FeCl2溶液与Cl2反应的离子方程式是。证明FeCl2与Cl2发生了氧化还原反应的实验方法是。
②丙装置中通入少量Cl2,可制得某种生活中常用的漂白、消毒的物质。该物质可能是。
| A.Cl2 | B.NaClO | C.Na2CO3 | D.Na2O2 |