甲、乙、丙三种物质的溶解度曲线如图所示。
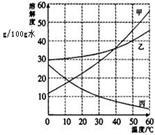
(1)20℃时,甲、乙、丙三种物质的溶解度由大到小的顺序是
(2)50℃时,35克乙物质的饱和溶液中,含乙物质 克。
(3)若要配制溶质质量分数相等的甲和乙的饱和溶液,温度应控制在 ℃。
(4)若分别将100克甲、乙、丙三种物质的饱和溶液从50℃降温至10℃,所得溶液的质量由多到少的顺序是 。
(5)甲中混有少量的杂质乙,若想得到较为纯净的甲,可以采用的方法是 。小明用提纯后的甲固体和水配制一定质量、一定溶质质量分数的甲溶液,其操作步骤是: 、称量和量取、 、装瓶贴标签。经检测,小明所配溶液中甲溶质质量分数偏小,其原因可能是 (填序号)。
Ⅰ.甲固体仍然不纯 Ⅱ.溶解前,烧杯中有少量水
Ⅲ.量取水时,俯视读数 Ⅳ.装瓶时,有少量溶液洒出
随着人们生活水平的提高,环保,能源问题越来越引起人们的重视.
(1)人们使用的燃料大多来自化石燃料,如煤、石油、 .煤燃烧时排放出SO2、NO2等污染物,这些气体或气体再空气中发生反应后的生成物溶于雨水,会形成 .
(2)科学家发现海底埋藏着大量将来可能会替代化石燃料的新能源是 .
(3)日常生活处理垃圾时,通常将垃圾分为“厨余垃圾”、“可回收垃圾”、“不可回收垃圾”和“其他垃圾”四大类,根据此分类方法,纸张、金属和塑料瓶属于 .
化学与工农业生产联系密切.
(1)NH4H2PO4是一种复合肥料,它所含植物必须的营养元素是 和 .
(2)农业上,可以用 溶液来选种.
(3)炼铁的主要反应原理是高温下,用 把铁从铁矿石里还原出来.
过氧化氢溶液俗称双氧水,在实验室中可用来制取氧气,其反应的化学方程式为 .过氧化钠是一种淡黄色固体,由单质钠与氧气在加热条件下反应得到,它的组成与过氧化氢类似.在潜水艇中它被用作供氧剂.当它与人体呼出的二氧化碳气体反应后,生成氧气和一种盐,这个反应的化学方程式为 .
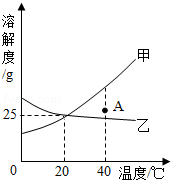
如图是甲、乙两种物质的溶解度曲线。
(1)由该图可以看出,甲、乙两种物质中,溶解度随温度的升高而增大的物质是 。
(2)甲、乙两物质的溶解度相等时的温度是 ℃.对应溶液溶质的质量分数是 。
(3)A点表示甲物质在40℃时的不饱和溶液。若在溶质质量不变的情况下,要达到饱和状态需 。
请在A﹣﹣H八种物质中,选择符合题意的物质,用字母填空.
| A. |
氮气 |
B. |
塑料饭盒 |
C. |
铝 |
D. |
可燃冰 |
E. |
醋酸 |
F. |
鸡肉 |
G. |
蔬菜 |
H. |
二氧化碳 |
(1)含有丰富维生素的是 .
(2)海底富含甲烷的固体燃料是 .
(3)在空气中体积分数约为78%的气体是 .
(4)富含蛋白质的是 .
(5)属于金属单质的是 .
(6)随便丢弃会造成"白色污染"的是 .
(7)pH小于7的是 .
(8)能使澄清石灰水变浑浊的气体是 .