运用元素周期律研究元素及其化合物的性质具有重要的意义。
I.部分短周期主族元素的最高价氧化物对应的水化物(浓度均为0.01mol.L-1)溶液的PH和原子序数的关系如下图所示。

元素R在周期表中的位置是________________________。
元素Y和W形成的Y2W2型化合物中含有化学键的类型为_____________。
测定Z元素最高价氧化物对应水化物溶液物质的量浓度的方法为______________。
II.短周期元素C、O、S能形成多种化合物,如CO2、CS2、COS等。
下列能说明碳、硫两种元素非金属性相对强弱的是____________(填序号)
A.相同条件下水溶液的PH:Na2CO3>Na2SO4
B.酸性:H2SO3 >H2CO3
C.CS2中碳元素为+4价,硫元素为-2价
羰基硫(COS)可作为一种熏蒸剂,能防止某些昆虫的危害,其分子结构和CO2相似。
①羰基硫(COS)的电子式为:______________。
②羰基硫(COS)用氢氧化钠溶液处理及利用的过程如下:

已知A是一种正盐,则A的化学式为______________;若气体a为单质,反应II的离子方程式为________________________________________________。
下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是由第三周期元素组成的单质中熔点最高的金属, K是一种红棕色气体。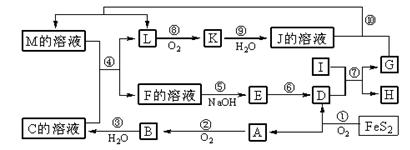
请填写下列空白:
(1)在周期表中,组成单质G的元素位于第__________周期_________族。
(2)在反应⑦中氧化剂与还原剂的物质的量之比为。
(3)在反应②、③、⑥、⑨中,既属于化合反应又属于非氧化还原反应的是。(填写序号)
(4)反应④的离子方程式是:。
(5)将化合物D与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O。该反应的化学方程式是:。
短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示。请回答下列问题:
| B |
C |
D |
||
| A |
E |
(1)B、C、D元素的非金属性由大到小的顺序为;(填元素符号)
(2)E的氢化物与其最高价氧化物对应水化物的钾盐共热能发生反应,生成一种气体单质。反应的化学方程式为;
(3)C有多种氧化物,其中甲的相对分子质量最小,在一定条件下2L甲气体与0.5L氧气相混合,若该气体混合物被足量的NaOH溶液完全吸收后没有气体残留,所生成的含氧酸盐的化学式是;
(4)在298K下,A、B的单质各1 mol 完全燃烧,分别放出热量aKJ和bKJ,又知一定条件下,A的单质能将B从它的最高价氧化物中置换出来。若此置换反应生成3mol B的单质,则该反应在298K下的△H (注:题中所设单质的为稳定单质)。
(5)要证明与D同主族且相邻的元素的非金属性与E的非金属性强弱,正确、合理的实验操作及现象是。
由中学化学常见元素组成的单质A、B、C和甲、乙、丙、丁、戊五种化合物有下图所示转换关系,A是由地壳中含量最多的金属元素组成的。请回答:
(1)写出下列物质的化学式:乙、丁、戊。
(2)写出甲物质在工业上的一种主要用途:。
(3)写出甲→乙+丙反应的离子方程式:;
A→乙+C反应的化学方程式:
(6分)(1)Na2O2可用在潜水艇里作为氧气的一种来源,供人们呼吸所需。Na2O2所发生反应的化学方程式为
(2)钠和水反应的化学方程式
(3)铝和氢氧化钠溶液反应的化学方程式
用双线桥标出下列反应中的电子转移的方向及数目,并指出氧化剂和还原剂
(1)3Cu+8HNO3===3Cu(NO3)2+2NO↑+4H2O
氧化剂是,还原剂是,
(2)2FeCl3+2HI=2FeCl2+2HCl+I2
氧化剂是,还原剂是