铜锌原电池(如下图)工作时,下列叙述正确的是( )
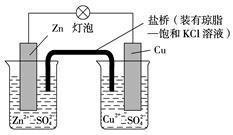
| A.正极反应为:Zn -2e-===Zn2+ |
| B.电池反应为:Zn+Cu2+=== Zn2++Cu |
| C.在外电路中,电子从正极流向负极 |
| D.盐桥中的K+ 移向ZnSO4溶液 |
150℃时,1L混合烃与9L氧气混合,在密闭容器内充分燃烧,当恢复到150℃时,容器内压强增大8%,则该混合烃的组成是
| A.甲烷:乙烷=1:1 | B.丙炔:乙炔=1:4 |
| C.乙烯:丁烷=1:4 | D.乙烯:丁烯=1:4 |
下列有关实验的说法中错误的是
| A.在蒸馏的实验中,温度计的水银球位于支管口处是为了测出馏分的沸点; |
| B.制取一氯乙烷最好采用的方法是乙烷和氯气在光照条件下反应 |
| C.在重结晶的实验中,使用短颈漏斗趁热过滤是为了减少被提纯物质的损失 |
| D.作为重结晶实验的溶剂,杂质在此溶剂中的溶解度受温度影响应该很大 |
由HOCH2 CH2COOH和CH3CH(OH)COOH组成的混合物,在浓硫酸的作用下发生两个分子
CH2COOH和CH3CH(OH)COOH组成的混合物,在浓硫酸的作用下发生两个分子 间的酯化反应,得到的各种酯共有
间的酯化反应,得到的各种酯共有
| A.8种 | B.7种 | C.6种 |
D.4种 |
下列取代基或微粒中,碳原子都满足最外层 为8电子结构的是
为8电子结构的是
| A.乙基(—CH2CH3) | B.碳正离子[(CH3)3C+] | C.碳化钙 (CaC2) | D.碳烯 (:CH2) |
除去下列物质中所含少量杂质(括号内为杂质),所选用的试剂和分离方法能达到实验目的的是
| 混合物 |
试剂 |
分离方法 |
|
| A |
苯(苯酚) |
氢氧化钠溶液 |
分液 |
| B |
乙烷(乙烯) |
氢气 |
加热 |
| C |
乙酸乙酯(乙酸) |
NaOH溶液 |
蒸馏 |
| D |
乙醇 (水) |
新制的氧化钙 |
蒸馏 |