离子方程式CO32-+2H+===H2O+CO2↑中的CO32-代表的物质可以是
| A.CaCO3 | B.NaHCO3 | C.Na2CO3 | D.BaCO3 |
下列应用或事实与胶体的性质无关的是()
| A.阳光透过墙上的小孔在较暗的房间里形成一道道光柱 |
| B.用石膏或盐卤制豆腐 |
| C.向FeCl3溶液中滴加NaOH溶液出现红褐色沉淀 |
| D.长江三角洲的形成 |
进行化学实验时应强化安全意识。下列做法正确的是()
| A.金属钠着火时使用泡沫灭火器灭火 |
| B.加热碳酸氢钠固体时使试管竖直向上 |
| C.浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 |
| D.实验室制取少量的氯气,在通风橱内进行 |
用石墨作电极电解100 mL H2SO4与CuSO4的混合液,通电一段时间后,两极均收集到2.24 L气体(标准状况),则原混合液中Cu2+的物质的量浓度为
| A.1 mol·L-1 | B.2 mol·L-1 | C.3 mol·L-1 | D.4 mol·L-1 |
如右图所示,a、b是多孔石墨电极,某同学按图装置进行如下实验:断开K2,闭合K1一段时间,观察到两只玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转。下列说法不正确的是
| A.断开K1,闭合K2时,b极上的电极反应式为:2H++2e-=H2↑ |
| B.断开K1,闭合K2时,OH-向b极移动 |
| C.断开K2,闭合K1时,a极上的电极反应式为:4OH--4e-=O2↑+2H2O |
| D.断开K2,闭合K1,一段时间后溶液的pH值要变大 |
如图两个电解槽中,A、B、C、D均为石墨电极。如果电解过程中共有0.02 mol电子通过,下列叙述中正确的是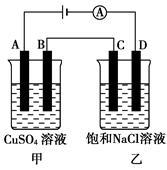
A.甲烧杯中A极上最多可析出铜0.64 g
B.甲烧杯中B极上电极反应式4OH--4e-=2H2O+O2↑
C.乙烧杯中滴入酚酞试液,D极附近变红
D.乙烧杯中C极上电极反应式为4H++4e-===2H2↑