10 ℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
| 温度(℃) |
10 |
20 |
30 |
加热煮沸后冷却到50 ℃ |
| pH |
8.3 |
8.4 |
8.5 |
8.8 |
甲同学认为:该溶液pH升高的原因是HCO的水解程度增大,碱性增强。
乙同学认为:该溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度________NaHCO3的水解程度(填“大于”或“小于”)。
丙同学认为甲、乙的判断都不充分。丙认为:
(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则________(填“甲”或“乙”)的判断正确。试剂X是________。
A.Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清石灰水
(2)将加热煮沸后的溶液冷却到10 ℃,若溶液的pH________8.3(填“高于”、“低于”或“等于”),则________(填“甲”或“乙”)判断正确。
(3)查阅资料,发现NaHCO3的分解温度为150 ℃,丙断言________(填“甲”或“乙”)判断是错误的,理由是_____________________。
(4)关于NaHCO3饱和水溶液的表述正确的是_______________________。
a.c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
b.c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-)
c.HCO3-的电离程度大于HCO3-的水解程度
把0.4 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:4X(g)+5Y(g)===nZ(g)+6W(g);2 min末已生成0.3 mol W,若测知以Z的浓度变化表示的反应速率为0.05 mol·(L·min)-1。试计算:前2 min内用X的浓度变化表示的平均反应速率为____________________;2 min末时Y的浓度为________________;化学方程式中n的值是________。
为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题。
| 编号 |
操作 |
实验现象 |
| ① |
分别在试管A、B中加入5 mL 5% H2O2溶液,各滴入2滴1 mol/L FeCl3溶液。待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡。 |
试管A中不再产生气泡; 试管B中产生的气泡量增大。 |
| ② |
另取两支试管分别加入5 mL 5% H2O2溶液和5 mL 10% H2O2溶液 |
试管A、B中均未明显见到有气泡产生。 |
(1)过氧化氢分解的化学方程式为__________________________________________。
(2)实验①的目的是______________________________________________________。
实验中滴加FeCl3溶液的目的是_________________________________________。
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是__________________________________(用实验中所提供的几种试剂)。
(4)某同学在50 mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如下图所示,则A、B、C三点所表示的瞬时反应速率最快的是______________________。
将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如下图所示装置。试回答下列问题: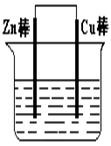
(1)若电解质溶液为稀硫酸,则Zn棒为原电池的极,可观察到Cu棒的所产生现象是,写出该电极反应式:。
(2)若电解质为硫酸铜溶液,则Cu棒上发生反应,Zn棒上发生反应的电极反应式为:。
下表是元素周期表的一部分,回答下列问题:
| 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
① |
② |
③ |
④ |
||||
| 3 |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
 |
 |
(1)写出③、⑤两种元素形成的化合物有两种,化学式是:,。
(2)上面主族元素中原子半径最大的是,非金属性最强的是。
(3)这些元素的最高价氧化物的水化物中,酸性最强的是___________(填化学式,下同);碱性最强的是________;能形成两性氢氧化物的元素是________。
元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p 轨道上有4个电子。元素Z 的原子最外层电子数是其内层的3倍。
(1)X与Y所形成化合物晶体的晶胞如图所示。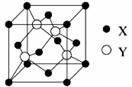
①在1个晶胞中,X离子的数目为。
②该化合物的化学式为。若其晶胞边长为540.0pm,则密度为,X与最近的Y之间的距离为
(2)在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是。
(3)Y 与Z 可形成YZ42-
①YZ42-的空间构型为(用文字描述)。
②写出一种与YZ42-互为等电子体的分子的化学式:。
(4)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目为。