氯碱工业是最基本的化学工业之一,它的产品除应用于化学工业本身外,还广泛应用于轻工业、纺织工业、冶金工业、石油化学工业以及公用事业。考虑到生产实际经济效益吸收氯碱工业的尾气氯气最好采用( )
| A.浓NaOH溶液 | B.饱和食盐水 | C.石灰乳 | D.浓硫酸 |
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的:①NaOH固体 ②H2O ③NH4Cl固体 ④CH3COONa固体 ⑤NaNO3固体 ⑥KCl溶液
| A.②④⑥ | B.①② | C.②③⑤ | D.②④⑤⑥ |
下图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,
下列有关说法中不正确的是 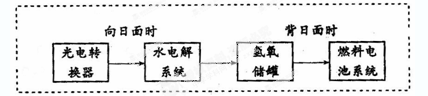
| A.该能量转化系统中的水也是可以循环的 |
| B.燃料电池系统产生的能量实际上来自于水 |
| C.水电解系统中的阳极反应:4OH-―4e-=2H2O+O2↑ |
| D.燃料电池放电时的负极反应:H2-2e-+2OH-=2H2O |
今有下列三个氧化还原反应:
①2FeCl3+2KI===2FeCl2+2KCl+I2
②2FeCl2+Cl2===2FeCl3
③2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O
若某溶液中有Fe2+、I-、Cl-共存,要除去I-而不氧化Fe2+和Cl-,则可加入的试剂是
| A.Cl2 | B.KMnO4 | C.HCl | D.FeCl3 |
用石墨做电极电解足量CuSO4溶液。通电一段时间后,欲使用电解液恢复到初始状态,可向溶液中加入适量的
| A.CuSO4 | B.CuO |
| C.H2O | D.CuSO4·5H2O |
要使工业废水中的重金属离子Pb2+沉淀,可用硫酸盐、碳酸盐、硫化物等作沉淀剂。
已知Pb2+与这些离子形成的化合物的溶解度如下表:
| 化合物 |
PbSO4 |
PbCO3 |
PbS |
| 溶解度/g |
1.03×10-4 |
1.81×10-7 |
1.84×10-14 |
由上述数据可知,选用的沉淀剂最好为
A.硫酸盐B.碳酸盐
C.硫化物D.任何一种即可