简答题:
(1)蒸馒头时,经常往面粉中放入小苏打,使得馒头膨松,食用起来香甜可口,请写出其原因:
(2)不能用手拿钠的原因:
(3)常温下,浓硫酸、浓硝酸可以用铝槽车运载的原因:
(15分)
某有机物X(C12H13O6Br)遇到FeCl3溶液显紫色,其部分结构简式如下: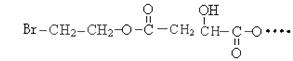
已知加热X与足理的NaOH水溶液反应时,得到A、B、C三种有机物,其中C中含
碳原子最多。室温下A经盐酸酸化可得到苹果酸E,E的结构简式为: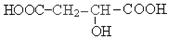
请回答:
(1) B中含有的官能团为。(填名称)
(2)1molX与足量的NaOH水溶液充分反应,消耗NaOH的物质的量为。
(3)C经酸化可得到有机物G,G不能发生的反应类型有(填序号)。
①加成反应②消去反应③氧化反应④取代反应
(4)1 molC酸化后与足量浓溴水充分反应需mol Br2 。
(5) E在浓H2SO4作用下可生成六元环状化合物,其化学方程式为。
(6)E的两种同分异构体F、G有如下特点:1molF或G可以和3molNa发生反应,放出标准状况下33.6LH2,1molF或G可以和足量NaHCO3溶液反应,生成1molCO2,1molF或G还可以发生银镜反应,生成2molAg。则F和G的结构简式分别是、。
(15分)
Ⅰ. 砷化镓为第三代半导体,以其为材料制造的灯泡寿命长.耗能少。已知砷化镓的晶胞结构如图所示。请回答下列问题:
(1)下列说法正确的是__________(填序号)
| A.砷化镓晶胞结构与NaCl相同 | B.第一电离能 As>Ga |
| C.电负性 As>Ga | D.原子半径 As>Ga |
(2)砷化镓可由(CH3)3Ga和AsH3在700℃下反应制得,反应的方程式为__________;
(3)AsH3空间形状为___________;已知(CH3)3Ga为非极性分子,则其中镓原子的杂化方式为____________;
Ⅱ.金属铜的导电性仅次于银,居金属中的第二位,大量用于电气工业。
(4)请解释金属铜能导电的原因, Cu2+的核外电子排布式为__________________________。
(5)在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到深蓝色的[Cu(NH3)4]SO4晶体,晶体中含有的化学键除普通共价键外,还有和。
(15分)
我国有丰富的天然气资源。以天然气为原料合成尿素的主要步骤如下图所示(图中某
些转化步骤及生成物未列出):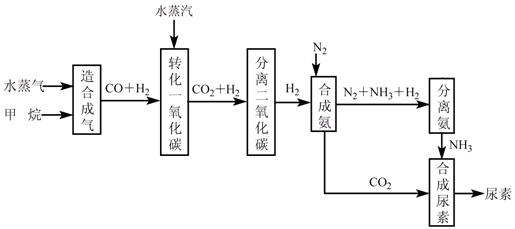
请填写下列空白:
(1)已知0.5 mol甲烷和0.5 mol水蒸气在t ℃,p k Pa时,完全反应生成一氧化碳和氢气(合成气),吸收了a kJ热量。该反应的热化学方程式是: ______。
(2)上述流程中,工业上分离H2、CO2合理的方法是___________。
| A.混合气先通入氢氧化钠溶液,再在溶液中加盐酸 |
| B.混合气加压冷却,使CO2液化 |
| C.混合气用氨水洗涤 |
| D.混合气先通入到石灰浆,然后高温煅烧固体, |
(3)为了保证氨气顺利合成,在空气进入合成塔之前必须对空气进行___________,目的是________________________________________;在合成氨的实际生产过程中,常采取将生成的氨从混合气体中分离出来,分离出氨的方法:。
(4)合理地利用资源不仅可以提高经济效益,而且也是对社会、对全人类负责的表现,请用线段和箭头画出图中的两处合理利用资源情况。
(14分).A、B、C、 D、 E五种溶液分别是NaOH、 NH3·H2O、 CH3COOH 、HCl 、NH4HSO4中的一种。常温下进行下列实验:
①将1 L pH=3的A溶液分别与0.001mol·L-1xL B溶液、0.001mol·L-1yL D溶液充
分反应至中性,x、y大小关系为: y<x;
②浓度均为0.1mol·L-1A和E溶液,pH:A<E;
③浓度均为0.1mol·L-1C与D溶液等体积混合,溶液呈酸性。
回答下列问题:
(1)D是溶液,判断理由是。
(2) 用水稀释0.1 mol·L-1B时,溶液中随着水量的增加而减小的是(填写序号)
①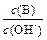 ;②
;②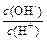 ;
;
③c(H+)和c(OH-)的乘积④ OH-的物质的量
(3)OH-浓度相同的等体积的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是________(填写序号)
①反应所需要的时间E>A②开始反应时的速率A>E
③参加反应的锌粉物质的量A="E" ④反应过程的平均速率 E>A
⑤A溶液里有锌粉剩余⑥E溶液里有锌粉剩余
(4)将等体积、等物质的量浓度B和C混合后溶液,升高温度(溶质不会分解)溶液pH随温度变化如下图中的_________曲线(填写序号) 。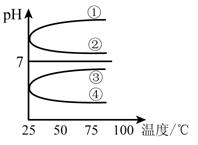
(5)室温下,向0.01mol·L-1 C溶液中滴加0.01mol·L-1 D溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为_______________。
下图是部分常见元素的单质及其化合物的转化关系图(有关反应的条件及生成的部分产物已略去)。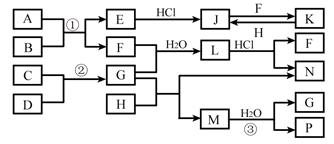
已知:E为红棕色固体,K为浅绿色溶液;反应①、②都是化工生产中的重要反应;B、C、D、H是单质;B、C、D、F、G、H常温下是气态; F、P 和H的水溶液均具有漂白作用,且F是形成酸雨的主要物质之一;N是一种常见的氮肥;化合物G为四原子10电子分子,化合物M由两种元素组成,分子内共有58个电子。
(1)写出F的化学式、P的电子式;
(2)在G的水溶液中,阳离子浓度最大的是(用离子符号表示)
(3)写出K与H反应的离子方程式;G与H反应的化学方程式
(4)在实验室中,向饱和H水溶液中加入CaCO3粉末,充分反应后过滤,可制得浓度较大的P的水溶液。用化学平衡移动的原理加以解释。