与我国的“神舟六号”采用液态燃料作推进剂不同,美国的航天飞机用铝粉与高氯酸铵(NH4ClO4)的混合物为固体燃料,点燃时铝粉氧化放热引发高氯酸铵反应,其方程式可表示为2NH4ClO4═N2↑+4H2O+Cl2↑+2O2↑ ΔH<0,下列对此反应的叙述 错误的是( )
| A.上述反应属于分解反应 |
| B.上述反应瞬间产生大量高温气体推动航天飞机飞行 |
| C.反应从能量变化上说,主要是化学能转变为热能和动能 |
| D.在反应中高氯酸铵只起氧化剂作用 |
用下列装置进行相应实验,能达到实验目的的是
| A.用图1所示配制一定浓度的稀硫酸 |
| B.用图2装置实验室制取氨气 |
| C.用图3装置蒸发饱和食盐水 |
| D.用图4装置制取、收集乙炔气体 |
制备下列物质的工业生产流程合理是
A.由SO2制亚硫酸钠: |
B.由NaCl制漂粉精: |
C.由NH3制硝酸: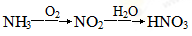 |
D.由乙烯制乙酸: |
设NA表示阿伏加德罗常数的值。下列说法正确的是
| A.1 mol Cl2与足量的Fe充分反应,转移电子的数目为3NA |
| B.常温下,1 L pH=1的H2SO4溶液中,由水电离出的H+数目为0.1NA |
| C.常温下,21 g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA |
D.1 mol 原子中所含中子数目为6NA 原子中所含中子数目为6NA |
下列有关物质的性质与应用对应关系不正确的是
| A.常温下铁与浓硝酸发生钝化,常用铁罐车运输浓硝酸 |
| B.SO2有漂白性,常用来漂白纸浆 |
| C.硅酸钠溶液呈碱性,常用作木材的防火剂 |
| D.Al具有良好延展性和抗腐蚀性,常用铝箔包装物品 |
常温下,下列各组离子在水溶液中能大量共存的是
| A.NH4+、Ag+、CO32—、SO42— | B.Fe2+、H+、NO3—、Cl- |
| C.Al3+、NH4+、HCO3—、Cl- | D.K+、Na+、NO3—、SO42— |