控制适合的条件,将反应2Fe3++2I- 2Fe2++I2设计成如图所示的原电池。下列判断不正确的是( )
2Fe2++I2设计成如图所示的原电池。下列判断不正确的是( )

| A.反应开始时,乙中石墨电极上发生氧化反应 |
| B.反应开始时,甲中石墨电极上的Fe3+被还原 |
| C.电流计读数为零时,反应达到化学平衡状态 |
| D.电流计读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极 |
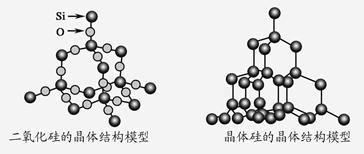
化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差,参考下表键能数据和晶体硅与二氧化硅结构模型,估算晶体硅在氧气中燃烧生成二氧化硅晶体的热化学方程式:Si(s)+O2(g)===SiO2(s)中,ΔH的值为
| 化学键 |
Si—O |
O=O |
Si—Si |
Si—Cl |
Si—C |
| 键能kJ·mol-1 |
460 |
498.8 |
176 |
360 |
347 |
A.-989.2 kJ·mol-1B.+989.2 kJ·mol-1
C.-61.2 kJ·mol-1D.-245.2 kJ·mol-1
X、Y、Z是位于不同周期的三种短周期元素,且原子序数逐渐增大,X、Z属于同一主族,三种元素可以形成原子个数比为1:1:1的化合物W。下列推测正确的是
| A.元素Z的氧化物一定属于碱性氧化物 |
| B.原子半径关系是:X<Y<Z |
| C.三种元素中,Y的金属性最强 |
| D.Y、Z都能形成含氧酸,且前者的酸性比后者酸性强 |
常温下,下列各组粒子在指定体系中一定能大量共存的是
| A.遇苯酚变紫色的溶液:Na+、Mg2+、SO42-、H2O2 |
| B.使甲基橙变红色的溶液:NH4+、Cu2+、ClO-、Cl- |
| C.0.1mol/LNaHCO3溶液:K+、AlO2-、Cl-、NO3- |
| D.0.1 mol·L-1 (NH4)2Fe(SO4)2溶液中:K+、Cu2+、Cl-、Fe3+ |
下列实验可以达到预期实验目的的是
| 实验 |
实验内容 |
实验目的 |
| A |
将木炭与浓硫酸共热,得到的气体通入澄清石灰水 |
检验木炭的氧化产物是CO2 |
| B |
加入足量铁屑,充分反应后,过滤 |
除去FeCl2溶液中的少量FeCl3 |
| C |
将1moLCuSO4·5H2O溶解在1L水中 |
制备1moL/L的CuSO4溶液 |
| D |
饱和氯化铁溶液中滴加氨水 |
制备Fe(OH)3胶体 |
常温下,下列各组物质中,Y既能与X反应又能与Z反应的是
| 编号 |
X |
Y |
Z |
| ① |
NaOH溶液 |
Al(OH)3 |
稀硫酸 |
| ② |
KOH溶液 |
SiO2 |
浓盐酸 |
| ③ |
O2 |
N2 |
H2 |
| ④ |
FeCl3溶液 |
Cu |
浓硝酸 |
A.①③ B.①④ C.②④ D.②③