小华总结所做的物理探究实验发现:
(1)当要研究的物理量不易直接测量时,都要想办法把它们的大小间接表示出来,这种研究物理问题的方法叫转换法。
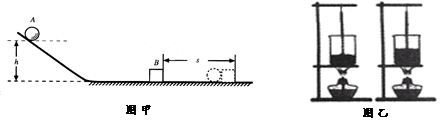
探究动能的大小与哪些因素有关 比较水和沙子吸热本领的大小
如图:甲实验中小球动能的大小是通过观察比较 反映出来的。乙实验中水和沙子吸收热量的多少是用 (选填“加热时间”或“温度计示数”)来反映的.
(2)当要研究的物理量与多个因素有关时,都要采用 法。如图:甲实验研究小球动能的大小与速度的关系就要多次改变 的大小,同时控制小球的 不变. 乙实验中只有物质的 不同,其他因素必须控制相同(例如烧杯的规格相同、水和沙的 相等、酒精灯加热方式相同等)。
如图甲所示是探究“电流与电阻关系”的实验电路。

|
实验序号 |
电阻 |
电流 |
|
1 |
5 |
1.2 |
|
2 |
10 |
0.6 |
|
3 |
15 |
0.4 |
|
4 |
20 |
|
|
5 |
30 |
0.2 |
(1)由图甲可知,电压表与定值电阻 的连接方式是 联。根据滑片位置判断,此时 (选填“可以”或“不可以”)直接闭合开关进行实验;
(2)更换定值电阻闭合开关后,电压表示数发生改变。若要控制R两端电压不变,应通过下列哪一操作后再记录数据: (填字母序号);
A.电流表与电压表交换位置
B.移动滑动变阻器的滑片
(3)当 时,电流表示数如图乙所示,则表格空白处应记录的电流为 ;
(4)分析表格中的实验数据可得结论:当电压一定时,电流与电阻成 。
小华同学在“探究电流与电阻关系”的实验时,定值电阻 有 、 、 三种规格, 为滑动变阻器,电源电压保持 不变。

(1)为能完成实验,用笔画线将图甲连接完整。
(2)小华首先将阻值为 的电阻接入电路,闭合开关后,发现电流表指针向左偏转如图乙所示,其原因可能是 。
(3)改正电路后,闭合开关,移动滑片 ,当电压表示数为 时,记录电流表的示数,作为第一组数据;接下来用 的电阻替换 的电阻做实验,移动滑片 ,使电流表的示数为 A时,作为第二组数据,然后将 的电阻替换 的电阻继续实验,并正确记录数据,根据实验数据总结得出:在电压一定时,电流与电阻成反比。
在“探究浮力的大小跟哪些因素有关”的实验时,小丽将一个物块挂在弹簧测力计下,并逐渐使其浸入水中,实验过程和对应的实验数据如图甲、乙、丙、丁、戊所示。
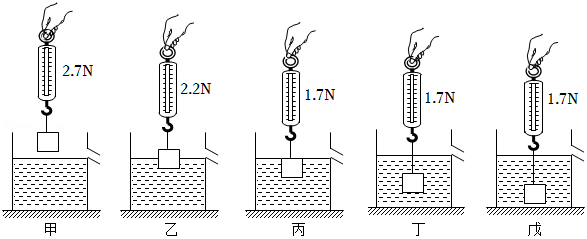
(1)由图甲、丙可知,物体浸没在水中时,受到的浮力为 N。
(2)分析图甲、乙、丙可知物体所受浮力大小与 (填“排开液体”或“物体”)的体积有关。
(3)分析图 可知,物体所受浮力与它浸没在水中的深度无关。
某同学用图甲的装置“探究水沸腾时温度变化特点”的实验:
(1)实验前调整器材时,图甲中应该先调节 (填“A”或“B”)的高度。
(2)图乙是两组同学分别根据实验数据绘制温度随时间变化的曲线Ⅰ和Ⅱ,由图线可知水沸腾时的特点是 ,由图还可以知道,沸腾前Ⅰ、Ⅱ两条图线不重合的原因是水的 (填“初始温度”或“质量”)不同。

如图1甲所示是“测量小灯泡的电阻”的实验电路图。
(1)请根据图1甲所示电路图,用笔画线代替导线完成图乙未连接好的实物电路(要求滑片P向右移动时小灯泡变亮);
(2)电路连接好后闭合开关,发现电流表有示数,电压表无示数,小灯泡不亮,如果电路只有一个元件有故障,该故障可能是小灯泡 ;
(3)排除故障后,继续进行实验,小灯泡正常发光时电压表示数如图1丙所示,其读数为 V;
(4)根据实验数据,作出小灯泡工作时 的关系图像如图2所示,则小灯泡正常发光时的电阻为 ;
(5)由图2可知,不同电压下,小灯泡电阻值不同,灯丝的电阻会随温度升高而变 ;
(6)若实验过程中发现电压表损坏,现增加一个已知阻值为 的定值电阻和一个开关,设计如图3所示的电路,也能测出小灯泡正常发光时的电阻,其实验步骤如下:
①闭合开关 ,断开开关 ,移动滑动变阻器的滑片 ,使电流表的示数为 ,并记录下来;
②保持滑动变阻器滑片 的位置不动,闭合开关 和 ,记下此时电流表的示数为 ;
③保持开关 和 闭合,移动滑动变阻器的滑片至最右端,记下此时电流表的示数为 ;
④则小灯泡正常发光时电阻的表达式为: (用 、 、 和 表示)。
