将一定量的二氧化碳通入100毫升某浓度的氢氧化钠溶液中得到溶液X,若向X中逐渐加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图所示,则下列分析与判断不正确的是(不计二氧化碳溶解)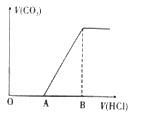
| A.若OA=AB,则溶液X为碳酸钠溶液 |
| B.若OA=0,则形成溶液X所发生反应的离子方程式为OH-+CO2=HCO3- |
| C.若OA>AB,则溶液X中大量存在的阴离子为碳酸根离子和碳酸氢根离子 |
| D.若3OA=AB,则溶液X中c(NaHCO3)=2c(Na2CO3) |
室温下,对于0.10 mol·L-1的氨水,下列判断正确的是
| A.其溶液中的c(OH-)=0.1mol·L-1 |
| B.加水稀释后,水电离出的c(OH-)变大 |
| C.加水稀释后,溶液中c(NH4+)·c(OH-)变大 |
| D.与AlCl3溶液发生反应的离子方程式为:Al3++3OH-===Al(OH)3↓ |
在密闭容器中进行反应:A(g)+3B(g) 2C(g),有关下列图像的说法不正确的是
2C(g),有关下列图像的说法不正确的是 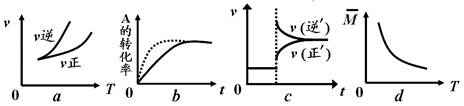
| A.依据图a可判断正反应为放热反应 |
| B.在图b中,虚线可表示使用了催化剂 |
| C.若正反应的△H<0,图c可表示升高温度使平衡向逆反应方向移动 |
| D.由图d中混合气体的平均相对分子质量随温度的变化情况,可推知正反应的△H>0 |
将BaO2放入密闭真空容器中,反应2BaO2(s) 2BaO(s)+O2(g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是
2BaO(s)+O2(g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是
| A.平衡常数减小 | B.BaO2量不变 |
| C.氧气压强不变 | D.BaO量不变 |
控制适合的条件,将反应2Fe3++2I- 2Fe2++I2设计成下图所示的原电池装置。
2Fe2++I2设计成下图所示的原电池装置。
下列判断不正确的是
| A.反应开始时,乙中石墨电极上发生氧化反应 |
| B.反应开始时,甲中石墨电极上Fe3+被还原 |
| C.电流计读数为零时,反应达到化学平衡状态 |
| D.电流计读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极 |
据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实,其反应方程如下:2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g)。下列叙述错误的是
CH3CH2OH(g)+3H2O(g)。下列叙述错误的是
| A.使用合适的催化剂可大大提高生产效率 |
| B.由反应需在300℃进行,可知该反应是吸热反应 |
| C.增大原料气中CO2的百分含量,可以提高H2的转化率 |
| D.70MPa的压力,不仅可以增加单位时间内的产出,还可以提高CO2和H2的利用率 |