物质的量浓度相等的三种溶液:①H2CO3②NaOH③Na2CO3溶液,下列说法不正确的是
| A.水电离出的c(OH):③>①>② |
| B.溶液的pH:②>③>① |
| C.①和②等体积混合后的溶液:c(Na+)=c(H2CO3)+c(HCO3)+c(CO32-) |
| D.①和③等体积混合后的溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) |
已知室温时,0.1 mol/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是()
| A.该溶液的pH=4 |
| B.升高温度,溶液pH增大 |
| C.此酸的电离平衡常数约为1×10-7 |
| D.由HA电离出的c(H+)约为水电离出的c(H+)的106倍 |
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)  2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确是( )
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确是( )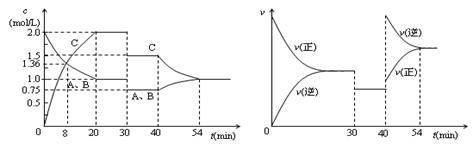
| A.8min前A的平均反应速率为0.08mol/(L·s) |
| B.30min时扩大容器的体积,40min时升高温度 |
| C.反应方程式中的x=1,正反应为吸热反应 |
| D.30min和54min的反应的平衡常数相等4 |
下列叙述正确的是()
| A.某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b |
| B.在滴有酚酞溶液的氨水中,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7 |
| C.1.0×10-3 mol/L盐酸的pH=3.0, 1.0×10-8 mol/L盐酸的pH=8.0 |
| D.若1 mL pH=1的盐酸与100 mL NaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11 |
25℃时向10V mL pH=a的盐酸中,滴加pH=b的NaOH溶液V mL时,溶液中Cl-物质的量恰好等于加入的Na+的物质的量,则a+b的值为()
| A.15 | B.14 | C.13 | D.不能确定 |
高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大.以下是某温度下这四种酸在冰醋酸中的电离常数
| 酸 |
HClO4 |
H2SO4 |
HCl |
HNO3 |
| Ka |
1.6×10-5 |
6.3×10-9 |
1.6×10-9 |
4.2×10-10 |
从以上表格中判断以下说法中不正确的是()
A.在冰醋酸中这四种酸都没有完全电离
B.在冰醋酸中高氯酸是这四种酸中最强的酸
C.在冰醋酸中硫酸的电离方程式为H2SO4=2H++SO
D.水对于这四种酸的强弱没有区分能力,但醋酸可以区别这四种酸的强弱