设NA为阿伏伽德罗常数的值。下列说法正确的是
①28 g由C2H4和C3H6组成的混合物中含有氢原子的数目为4 NA
②1 L 0.1 mol·L-1的氨水中含有NH3·H2O分子数为0.1NA
③1 mol Na2O2固体与足量CO2反应转移电子数为1NA
④标准状况下,2.24 L的二氯甲烷中含有的碳氯共价键的数目为0.2NA
| A.4个 | B.3个 | C.2个 | D.1个 |
25℃时。有c(CH3COOH)+ c(CH3COO-)=0.1mol/L的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-) 与pH的关系如图所示。下列有关溶液中离子浓度关系的叙述中正确的是。
| A.pH=5.5的溶液中c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) |
| B.W点所表示的溶液中c(Na+) + c(H+)=c(CH3COO-)+c(OH-) |
| C.pH=3.5的溶液中:c(Na+) + c(H+)-c(OH-)+c(CH3COOH)=0.1mol/L |
| D.向W点所表示的1L溶液中通入0.05molHCl气体(溶液的体积变化可忽略):c(H+)=c(OH-)+c(CH3COOH) |
在密闭容器中,放入镍粉并充入一定量CO气体,一定条件下发生反应:Ni(s)+4CO(g) Ni(CO)4(g),已知该反应在25℃和80℃时的平衡常数分别为5×104和2,下列说法正确的是
Ni(CO)4(g),已知该反应在25℃和80℃时的平衡常数分别为5×104和2,下列说法正确的是
| A.上述生成Ni(CO)4(g)的反应为吸热反应 |
| B.恒温恒压下,向容器中再充入少量的Ar,上述平衡将正向移动 |
| C.在80℃时,测得某时刻,Ni(CO)4 、CO浓度均为0.5 mol/L,则此时v正<v逆 |
| D.恒温恒容下,向容器中再充入少量Ni(CO)4(g),达新平衡时,CO 的百分含量将增大 |
向两份a mL b mol/L的稀盐酸中分别加入xmL的水和ymLbmol/LBa(OH)2溶液,此时两溶液的pH恰好相等,则x、y的关系符合(式中a、b均大于零,设两溶液混合时的体积有加和性)
| A.y=2ax+b | B.y=ax/(2x+3a) | C.a/2y-3a/2x=1 | D.x=2ay/(a+y) |
PbO2是褐色固体,受热分解为Pb的+4和+2+4价的混合氧化物,+4价的Pb能氧化浓盐酸生成Cl2;现将1mol PbO2加热分解得到O2,向剩余固体中加入足量的浓盐酸得到Cl2,O2和Cl2的物质的量之比为3∶2,则剩余固体的组成及物质的量比是
| A.1∶1混合的Pb3O4、PbO |
| B.1∶2混合的PbO2、Pb3O4 |
| C.1∶4∶1混合的PbO2、Pb3O4、PbO |
| D.4∶1∶1混合的PbO2、Pb3O4、PbO |
某实验兴趣小组设计如下微型实验装置。实验时,先断开S2,闭合S1,两极均有气泡产生;一段时间后,断开S1,闭合S2,发现电流表A的指针偏转,下列有关描述正确的是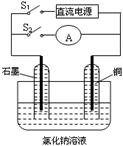
A.断开S2闭合S1时,总反应的离子方程式为:2H++2Cl- H2↑+Cl2↑ H2↑+Cl2↑ |
| B.断开S2闭合S1时,阳极附近溶液变红 |
| C.断开S1闭合S2时,铜电极上的电极反应为:Cl2+2e→2Cl- |
| D.断开S1闭合S2时,石墨电极作正极 |