某校兴趣小组对SO2与新制Cu(OH)2悬浊液的反应进行探究,实验如下:
| 装置 |
序号 |
试管中的药品 |
现象 |
持续通入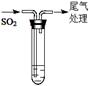 |
实验Ⅰ |
1.5 mL 1 mol·L-1 CuSO4溶液和3.5 mL 1 mol·L-1 NaOH溶液混合 |
开始时有砖红色沉淀出现,一段时间后,砖红色沉淀消失,静置,试管底部有少量紫红色固体,溶液呈绿色 |
| 实验Ⅱ |
1.5 mL 1 mol·L-1 CuCl2溶液和3.5 mL 1 mol·L-1 NaOH溶液混合 |
开始时有黄色沉淀出现,一段时间后,黄色沉淀消失,静置,生成大量白色沉淀,溶液呈绿色 |
(1)制取新制Cu(OH)2悬浊液的离子方程式为 。
(2)甲同学重新用实验II的方法制备新制Cu(OH)2悬浊液,过滤,用蒸馏水洗涤干净。向洗净后的Cu(OH)2中加入5 mL蒸馏水,再持续通入SO2气体,现象与实验I相同,此步实验证明: 。检验Cu(OH)2洗涤干净的方法是 。
(3)同学们对白色沉淀的成分继续进行探究。查阅资料如下:CuCl为白色固体,难溶于水,能溶于浓盐酸。它与氨水反应生成Cu(NH3)2+,在空气中会立即被氧化成含有蓝色Cu(NH3)42+溶液。
①甲同学向洗涤得到的白色沉淀中加入氨水,得到蓝色溶液,此过程中反应的离子方程式为:CuCl + 2NH3·H2O = Cu(NH3)2+ +Cl- + 2H2O 、 ____________ 。
②乙同学用另一种方法证明了该白色沉淀为CuCl,实验方案如下:
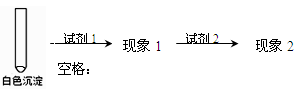
填写下表空格:
| 试剂1 |
|
试剂2 |
蒸馏水 |
| 现象1 |
|
现象2 |
|
③写出实验II中由Cu(OH)2生成白色沉淀的离子方程式: 。
(4)丙同学通过实验证明实验Ⅰ中观察到的砖红色沉淀是Cu2O。完成合理的实验方案:取少量Cu2O固体于试管中, _______________ ,则说明砖红色沉淀是Cu2O。
实验室欲配制80mL 1.4mol/L的NaNO3溶液,试回答:
(1)用不到的仪器是:;
A.烧杯 B.500mL容量瓶 C.量筒 D.胶头滴管 E.玻璃棒 F.100mL容量瓶
(2)配制时应称取NaNO3g;
(3)下列操作的顺序是(用字母表示);
A.冷却 B.称量 C.洗涤 D.定容 E.溶解 F.摇匀 G.转移
(4)在配制一定物质的量浓度溶液的实验中,下列操作对所配得溶液无影响的是(写序号);会使所配溶液的浓度偏大的是。
A.在烧杯中溶解溶质,搅拌时不慎溅出少量溶液;
B.未将洗涤烧杯内壁的溶液转移入容量瓶;
C.容量瓶中所配的溶液液面未到刻度线便停止加水;
D.将配得的溶液从容量瓶转移到干燥、洁净的试剂瓶中时,有少量溅出;
E.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水;
F.将容量瓶中液面将达到刻度线时,俯视刻度线和液面。
鸡蛋壳中含有大量钙、少量镁和钾等元素。实验室可用图示流程测定鸡蛋壳中钙、镁元素含量。依据的反应可以表示为:Ca2++Y2-=CaY、Mg2++Y2-=MgY。回答下列问题。
(1)测定Ca2+、Mg2+总含量时,控制溶液pH=10。若pH过大,测定结果将(填“偏大”、“偏小”或“无影响”)。
(2)如果鸡蛋壳粉质量为m g,溶液中Y2+浓度为c mol/L,则鸡蛋壳样品中镁元素质量分数是。
(3)有同学提出可采用如下装置,通过测定鸡蛋壳与盐酸反应产生的二氧化碳的量就能测定鸡蛋壳中的钙的总含量。
①采用该方法进行实验,各装置从左到右的连接顺序依次1→2→____________(填各装置对应接口的数字序号)。
②若排除实验仪器和操作的影响因素,此实验方法测得的结果是否准确?答:________(填“准确”、“不准确”或“无法判断”)。原因是。
现有3瓶没有标签的无色溶液,它们分别是NaHCO3、Ba(OH)2、H2SO4
中的各一种,某研究性学习小组探究“不用其它试剂即可鉴别”的方法。将试剂瓶分别编号为①、②、③。
⑴甲同学采用如下实验方案:
分别取样进行分组实验,现象如下表所示:
| ③ |
② |
① |
|
| ① |
↑ |
↓ |
|
| ② |
↓ |
↓ |
|
| ③ |
↓ |
↑ |
根据实验现象得出结论:②试剂为。
甲同学又做如下两个实验,鉴别①和③
请分析甲同学实验失败的可能原因:。
⑵乙同学采用如下实验方案:
乙同学采用甲同学同样的实验过程,鉴别出其中的②后,又做如下实验:
请分析乙同学实验失败的可能原因:。
⑶丙同学采用如下实验方案:
丙同学采用甲同学同样的实验过程,鉴别出其中的②后,又做如下实验: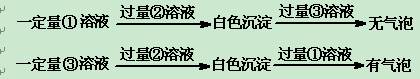
根据实验现象得出结论:①试剂为,③试剂为。
⑷丁同学参与甲、乙、丙三位同学的实验过程,发现当采用分组实验鉴别出②后,无需再进行任何实验操作,立即就可区分出另外两瓶试剂,他的方法是。
为检验在空气中暴置过的过氧化钠的变质程度,某学习小组的甲、乙、丙三位同学经研究讨论,为减小实验的误差,分工协作如下:分别用等量的过氧化钠样品进行实验。
⑴甲同学采用如图实验装置,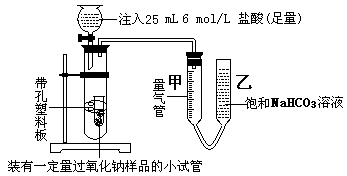
甲同学测量气体时,实验过程中,量气管甲的前后示数差为473 mL(已折成标准状况下的体积),实验后量气管甲中气体的主要成分有。
⑵乙同学采用如图实验装置,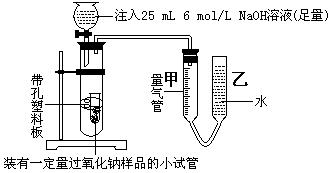
乙同学测量气体时,实验过程中,量气管甲的前后示数差为249 mL(已折成标准状况下的体积),乙同学的实验中,所用NaOH溶液的作用是:
①;
②。
⑶丙同学用浓度为1.00 mol/L的标准盐酸滴定过氧化钠样品,应选用的玻璃仪器有:
。
从实验目的分析丙同学所采用的指示剂为。丙同学实验完毕,从滴定管前后的示数得知消耗标准盐酸100.00 mL。
⑷利用上述实验数据,计算该过氧化钠样品变质的百分率为。指导教师在批阅该实验小组的实验报告时,指出两点不足,可能引起实验误差:
①;
②。
2006年世界锂离子电池总产量超过25亿只,锂电池消耗量巨大,对不可再生的金属资源的消耗是相当大的。因此锂离子电池回收具有重要意义,其中需要重点回收的是正极材料,其主要成分为钴酸锂(LiCoO2)、导电乙炔黑(一种炭黑)、铝箔以及有机粘接剂。某回收工艺流程如下: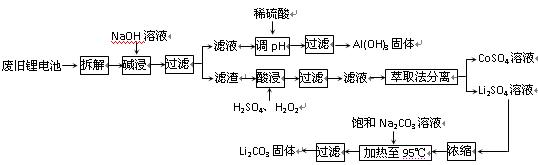
(1)上述工艺回收到的产物有。
(2)废旧电池可能由于放电不完全而残留有原子态的锂,为了安全对拆解环境的要求是_______________。
(3)碱浸时主要反应的离子方程式为_____________________。
(4)酸浸时反应的化学方程式为___________。如果用盐酸代替H2SO4和H2O2的混合液也能达到溶解的目的,但不利之处是_______________。
(5)生成Li2CO3的化学反应方程式为____________。已知Li2CO3在水中的溶解度随着温度升高而减小,最后一步过滤时应____________。