在T ℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g·cm-3,溶质的质量分数为w,其中含NH4+的物质的量为b mol。下列叙述中一定正确的是
A.溶质的质量分数为w= ×100% ×100% |
B.溶质的物质的量浓度c=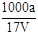 mol·L-1 mol·L-1 |
C.溶液中c(OH-)= mol·L-1 mol·L-1 |
| D.上述溶液中再加入VmL水后,所得溶液溶质的质量分数大于0.5w |
下列能达到实验目的的是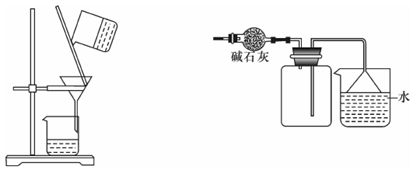
A.除去Fe(OH)3胶体中的FeCl3 B.干燥、收集氨气,并吸收多余的氨气
下列各组离子在指定的溶液中不能大量共存的是
| A.滴入KSCN溶液显红色的溶液中:K+、Fe2+、SO42–、Cl– |
| B.1 mol·L–1的烧碱溶液中:S2–、SO32–、S2–、K+ |
| C.使淀粉碘化钾试纸变蓝的溶液中:Cs+、Ba2+、S2–、Cl– |
| D.含有大量HCO3–的澄清透明溶液中:K+、NH4+、Cl–、Na+ |
分子式为C4H8O2,且能发生水解反应的有机物有(不考虑立体异构)
| A.2种 | B.3种 | C.4种 | D.5种 |
下列推断合理的是
| A.金刚石是自然界中硬度最大的物质,不可能与氧气发生反应 |
| B.将SO2分别通入品红和溴水溶液,溶液都会褪色,而且再经加热都能恢复原色 |
| C.浓H2SO4,具有强氧化性,不能与Cu发生剧烈反应 |
| D.明矾[KAl(SO4)2·12H2O]在水中能形成Al(OH)3胶体,可用作净水剂 |
“三效催化转换器”可将汽车尾气中的有毒气体处理为无污染的气体,下图为该反应的微观示意图(未配平),其中不同颜色的球代表不同种元素的原子。下列说法正确的是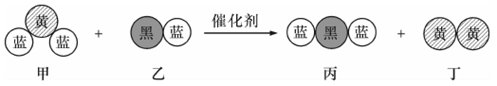
| A.该反应属于置换反应 |
| B.化学方程式中乙、丙的化学计量数均为4 |
| C.甲和丁中同种元素化合价相等 |
| D.甲和丙中所含元素种类相同 |