已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+。现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如右图所示,下列说法中不正确的是
| A.图中AB段的氧化剂为K2Cr2O7 |
| B.图中BC段发生的反应为2Fe3++2I—=2Fe2++I2 |
| C.开始加入的K2Cr2O7为0.25mol |
| D.K2Cr2O7与FeSO4反应的物质的量比为1∶3 |
质量分数为90%的硫酸溶液和10%的硫酸溶液等体积混合后,溶液中溶质的质量分数( )
| A.大于50% | B.等于50% | C.小于50% | D.不能作上述比较 |
露置的苛性钾经分析,其中含有的各种物质的质量分数分别为:H2O 7.62%,K2CO3 2.38%,KOH 90%。若将此样品1 g加入到1 mol·L-1的盐酸46.00 mL中,过量的盐酸用1.070 mol·L-1 KOH溶液恰好中和。蒸发中和后的溶液,可得固体()
| A.3.43 g | B.4.00 g |
| C.4.50 g | D.无法计算 |
实验室需要200 mL 1 mol·L-1的CuSO4溶液,下列有关配制该溶液的叙述,正确的是()
| A.称取32 g无水硫酸铜,加入200 mL水,在250 mL的容量瓶中配成溶液 |
| B.称取50 g CuSO4·5H2O,在250 mL的容量瓶中配成200 mL溶液 |
| C.称取40 g无水硫酸铜,加入250 mL水,在250 mL的容量瓶中配成250 mL溶液 |
| D.称取62.5 g CuSO4·5H2O,在250 mL的容量瓶中配成250 mL溶液 |
下表列出了四种溶液溶质的质量分数和物质的量浓度数值:
| 溶质 |
HCl |
HNO3 |
CH3COOH |
NaOH |
| 溶质的质 量分数/% |
36.5 |
63 |
40 |
40 |
| 物质的量浓 度/mol·L-1 |
11.8 |
13.8 |
10.6 |
14.3 |
则各溶液中密度最小的是()
| A.HCl | B.HNO3 |
| C.CH3COOH | D.NaOH |
一种硫酸溶液的浓度为c mol·L-1、密度为ρ g·cm-3,则这种溶液的质量分数为()
A.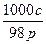 ×100% ×100% |
B.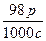 ×100% ×100% |
C.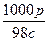 ×100% ×100% |
D. ×100% ×100% |