实验室用粗锌(含铅等杂质)与过量的稀硫酸反应制氢气的废液制备硫酸锌晶体,其流程如下:


已知ZnSO4的溶解度如下表所示:
| 温度/℃ |
0 |
10 |
20 |
30 |
40 |
60 |
80 |
100 |
| 溶解度/g |
41.6 |
47.5 |
53.8 |
61.3 |
70.5 |
75.4 |
71.1 |
60.5 |
(1)实验过程中多次用到如右图所示的过滤装置,仪器a的名称为 。
(2)滤渣Ⅰ的主要成分为 。X的化学式为 。
(3)溶解过程中加入的稀硫酸的作用是 。
(4)结晶的操作为 。
(5)用酒精进行洗涤的原因是 。
如图是实验室制取酚醛树脂的装置图(烧杯底部垫有石 棉网)。
棉网)。
(1)装置中的一处错误是______________________________
(2)试管上方长玻璃管的作用是_______________________________
(3)浓盐酸在该反应中的作用是_______________________________
(4)实验完毕后,若试管用水不易洗涤,可以加入少量_______浸泡几分钟,然后洗净。
实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品 。
。
请回答下列问题:
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入_________________________________。
(2)反应中加入过量的乙醇,目的是__________________________________________________。
(3)现拟分离粗产品乙酸乙酯、乙酸和乙醇的混合物下列框图是分离操作步骤流程图: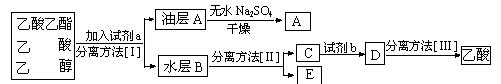
则试剂a是:______,分离方法I是______,分离方法II是______,
试剂b是________,分离方法III是_____________ _。
_。
某化学课外小组用下图装置制取溴苯
先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端
活塞关闭)中
(1)写出A中制取溴苯的化学方程式____________________.
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是_______,写出有关的化学方程式___________________.
(3)C中盛放CCl4的作用是____________________.
(4)为证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入溶液,观察到,则能证明.
简答:糖尿病是“富贵病”,请你设计实验检验病人尿液中的葡萄糖,并与正常人作对比,设计要求:
⑴写出实验所用化学药品
⑵写出实验现象并作出结论。
下图所示为某化学兴趣小组设计的乙醇氧化的实验装置(图中加热仪器、铁架台、铁夹等均未画出)。
图中:A为无水乙醇(沸点为78℃),B为绕成螺旋状的细铜丝,C为无水CuSO4粉末,D为碱石灰,F为新制的碱性Cu(OH)2悬浊液。
(1) E处是一种纯净物,其发生反应的化学方程式为___ _____。
(2)为使A中乙醇平稳汽化成乙醇蒸气,常采用的方法是_______ ______。
D处使用碱石灰的作用是__ _____。
(3)能证明乙醇反应后产物的实验现象是
。
(4)本实验中若不加热E处,其他操作不变,则发现C处无明显变化,而F处现象与(3)相同。推断B处发生反应的化学方程式____。