一定温度时,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应:2SO2(g)+O2(g) 2SO3(g) ∆H=−196kJ·moL−1,一段时间后达平衡,反应过程中测定的部分数据见下表:
2SO3(g) ∆H=−196kJ·moL−1,一段时间后达平衡,反应过程中测定的部分数据见下表:
| 反应时间/min |
n(SO2)/mol |
n(O2)/mol |
| 0 |
2 |
1 |
| 5 |
1.2 |
|
| 10 |
|
0.4 |
| 15 |
0.8 |
|
下列说法不正确的是
A.反应在前5min的平均速率为v (SO2)=0.08mol·L−1·min−1
B.保持温度不变,向平衡后的容器中再充入0.2molSO2和0.2mol SO3时,v (正)>v (逆)
C.保持其他条件不变,若起始时向容器中充入2molSO3,达平衡时吸收78.4kJ的热量
D.相同温度下,起始时向容器中充入1.5mol SO3,达平衡时SO3的转化率为40%
用CH4催化还原NOx可以消除氮氧化物的污染。
例如:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)ΔH2=-1 160 kJ·mol-1
若在标准状况下用CH4还原4.48 L NO2生成N2,则下列说法中正确的是
( )。
| A.该过程吸收的热量为86.7 kJ |
| B.此过程中需要标准状况下CH4气体1.12 L |
| C.转移的电子数为0.8NA |
| D.已知2NO(g)+O2(g)=2NO2(g) ΔH=-114 kJ·mol-1,则CH4的燃烧热是802 kJ·mol-1 |
已知:H+(aq)+OH-(aq)=H2O(l) ΔH1=-57.3 kJ·mol-1,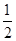 H2SO4(浓,aq)+NaOH(aq)=
H2SO4(浓,aq)+NaOH(aq)=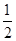 Na2SO4(aq)+H2O(l) ΔH2=m kJ·mol-1。下列说法正确的是 ( )。
Na2SO4(aq)+H2O(l) ΔH2=m kJ·mol-1。下列说法正确的是 ( )。
| A.上述热化学方程式中的化学计量数表示分子个数 |
| B.ΔH1>ΔH2 |
| C.ΔH2=-57.3 kJ·mol-1 |
| D.|ΔH1|>|ΔH2| |
下列反应中符合下图图像的是 ( )。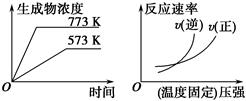
A.N2(g)+3H2(g) 2NH3(g) ΔH=-Q1 kJ·mol-1(Q1>0) 2NH3(g) ΔH=-Q1 kJ·mol-1(Q1>0) |
B.2SO3(g) 2SO2(g)+O2(g)ΔH=+Q2 kJ·mol-1(Q2>0) 2SO2(g)+O2(g)ΔH=+Q2 kJ·mol-1(Q2>0) |
C.4NH3(g)+5O2(g) 4NO(g)+6H2O(g)ΔH=-Q3 kJ·mol-1(Q3>0) 4NO(g)+6H2O(g)ΔH=-Q3 kJ·mol-1(Q3>0) |
D.H2(g)+CO(g) C(s)+H2O(g)ΔH=+Q4 kJ·mol-1(Q4>0) C(s)+H2O(g)ΔH=+Q4 kJ·mol-1(Q4>0) |
在298 K、100 kPa时,已知:
2H2O(g)=O2(g)+2H2(g) ΔH1
Cl2(g)+H2(g)=2HCl(g) ΔH2
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是 ( )。
| A.ΔH3=ΔH1+2ΔH2 | B.ΔH3=ΔH1+ΔH2 |
| C.ΔH3=ΔH1-2ΔH2 | D.ΔH3=ΔH1-ΔH2 |
下列各组变化中,ΔH或Q前者小于后者的一组是( )。
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH2
②2H2(g)+O2(g)=2H2O(l) ΔH1
H2(g)+ O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
③t ℃时,在一定条件下,将1 mol SO2和1 mol O2分别置于恒容和恒压的两个密闭容器中,达到平衡状态时放出的热量分别为Q1、Q2
④CaCO3(s)=CaO(s)+CO2(g) ΔH1
CaO(s)+H2O(l)=Ca(OH)2(s) ΔH2
| A.①②③ | B.②④ | C.②③④ | D.③④ |