氯酸钠(NaClO3)是无机盐工业的重要产品之一。
(1)工业上制取氯酸钠采用在热的石灰乳中通入氯气,然后结晶除去氯化钙后,再加入适量的 (填试剂化学式),过滤后即可得到。
(2)实验室制取氯酸钠可通过如下反应:3C12+6NaOH 5NaC1+NaC1O3+3H2O,先往-5℃的NaOH溶液中通入适量C12,然后将溶液加热,溶液中主要阴离子浓度随温度的变化如右图所示,图中C表示的离子是 。
5NaC1+NaC1O3+3H2O,先往-5℃的NaOH溶液中通入适量C12,然后将溶液加热,溶液中主要阴离子浓度随温度的变化如右图所示,图中C表示的离子是 。

(3)某企业采用无隔膜电解饱和食盐水法生产氯酸钠。则反应化学方程式为: 。
(4)样品中C1O3-的含量可用滴定法进行测定,步骤如下:
步骤1:准确称取样品ag(约2.20g),经溶解、定容等步骤准确配制1000mL溶液。
步骤2:从上述容量瓶中取出10.00mL溶液于锥形瓶中,准确加入25mL 1.000mol/L(NH4)2Fe(SO4)2溶液(过量),再加入75mL硫酸和磷酸配成的混酸,静置10min。
步骤3:再在锥形瓶中加入100mL蒸馏水及某种指示剂,用0.0200mol/L K2Cr2O7标准溶液滴定至终点,消耗体积15.62mL。
步骤4: 。
步骤5:数据处理与计算。
①步骤2中反应的离子方程式为 ;静置10min的目的是 。
②步骤3中K2Cr2O7标准溶液应盛放在 (填仪器名称)中。
③为精确测定样品中C1O3-的质量分数,步骤4操作为 。
(5)在上述操作无误的情况下,所测定的结果偏高,其可能的原因的原因是
【化学——有机化学基础】
下述反应是有机合成中常见的增长碳链的方法:
(1)有关化合物I的说法正确的是________。
| A.可发生取代、氧化等反应 |
| B.1mol化合物I最多能与4mol H2加成 |
| C.易溶于水、乙醇等溶剂 |
| D.属于芳香族化合物 |
(2)化合物Ⅱ的分子式为__________,lmol化合物Ⅱ与NaOH溶液反应最多消耗_____________mol NaOH.
(3)化合物III可与乙酸制备化合物Ⅱ,写出符合下列要求的III的同分异构体的结构简式______________.
a:遇FeCl3溶液显紫色b:核磁共振氢谱有3组峰
(4)利用此增长碳链的方法,写出以甲苯为原料,制备 的化学方程式_____________________,_____________________。
的化学方程式_____________________,_____________________。
【化学—物质结构与性质】
碳是形成化合物种类最多的元素。
(1)C、N、O三种元素的第一电离能由大到小的顺序为______,碳的最简单气态氢化物中心原子的杂化类型为___________。
(2)类肉素[(SCN)2]的结构式为N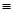 C—S—S—C
C—S—S—C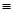 N。其分子中
N。其分子中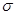 键和
键和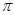 键的个数比为__________;该物质对应的酸有两种,理论上硫氰酸(H—S—C
键的个数比为__________;该物质对应的酸有两种,理论上硫氰酸(H—S—C N)的沸点低于异硫氰酸(H—N=C=S)的沸点,其原因是___________________。
N)的沸点低于异硫氰酸(H—N=C=S)的沸点,其原因是___________________。
(3)位于第四周期VIII族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同的元素,其基态原子的价层电子排布式为 ____________。
(4)碳化硅的结构与金刚石类似,其硬度仅次于金刚石,具有较强的耐磨性能,其晶胞结构如图所示(其中·为碳原子,○为硅原子)。每个碳原子周围与其距离最近的硅原子有_____个;设晶胞边长为a cm,密度为b g·cm-3,则阿伏加德罗常数可表示为__________(用含a、b的式子表示).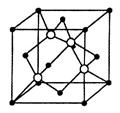
【化学——化学与技术】火山喷发所产生的硫磺可用于生产重要的化工原料——硫酸。某企业用下图所示的工艺流程生产硫酸:
请回答下列问题:
(1)①为充分利用反应放出的热量,转化器中应安装______(填设备名称)。吸收塔中填充有许多瓷管,其作用是________;
②为使硫磺充分燃烧,经流量计l通入燃烧室的氧气过量50%。为提高SO2转化率,经流量计2的氧气量为转化器中二氧化硫完全氧化时理论需氧量的2.5倍,则生产过程中流经流量计l和流量计2的空气体积比应为______。b管排出的尾气的处理方法是________.
③与以硫铁矿为原料的生产工艺相比,该工艺的特点是_________(填字母序号)。
A.耗氧量减少 B.二氧化硫的转化率提高
C.产生的废气减少 D.不需要使用催化剂
(2)硫酸的用途非常广泛;其中可应用于下列哪些方面__________(填字母序号)。
A.橡胶的硫化B.表面活性剂“烷基苯磺酸钠”的合成
C.铅蓄电池的生产D.过磷酸钙的制备
(3)矿物燃料的燃烧是产生大气中SO2的主要原因之一。在燃煤中加入适量的石灰石,可有效减少煤燃烧时SO2的排放,请写出此脱硫过程中反应的化学方程式___________________________
铁、铝及其化合物的应用十分广泛,请回答:
(1)在实验室中,硝酸铝必须与可燃物分开存放,是因为硝酸铝具有____________(填字母序号)。
A.可燃性B.氧化性 C.还原性
(2)已知:当Al(NO3),溶液中pH>3时,铝元素有多种存在形态,如A13+、[Al(OH)]2+、[Al(OH)2]+等,各形态之间可相互转化,写出该溶液中[Al(OH)]2+转化为[Al(OH)2]+的离子方程式_________________。
(3)氯化铁溶液常用作印刷电路铜板的腐蚀剂,反应的离子方程式为___________;从腐蚀废液中回收金属铜还需要的试剂是__________。
(4)铁红是一种红色颜料,其成分是Fe2O3,将一定量的铁红溶于160 mL5mol·L-1盐酸中,再加入一定量铁粉恰好溶解,收集到2.24L氢气(标准状况),溶液中铁元素的存在形式为________(填离子符号),检验该离子的实验操作、现象和结论是_________;参加反应的铁粉的质量为______________。
对氮及其化合物的研究具有重要意义。
(1)在1 L密闭容器中,4 mol氨气在一定条件下分解生成氮气和氢气。2 min时反应吸收热量为46.1 kJ,此时氨气的转化率为25%。该反应的热化学方程式为_____________,这段时间内v(H2)=_________。
(2)298K时.在2L固定体积的密闭容器中,发生可逆反应:2NO2(g) N2O4(g)
N2O4(g)  =-akJ·mol-1(a>0),N2O4的物质的量浓度随时间变化如图所示。达平衡时,N2O4的浓度为NO2的2倍。
=-akJ·mol-1(a>0),N2O4的物质的量浓度随时间变化如图所示。达平衡时,N2O4的浓度为NO2的2倍。
①298K时,该反应的化学平衡常数为_________(精确到0.01);
②下列情况不是处于平衡状态的是__________(填字母序号);
a.混合气体的密度保持不变
b.混合气体的颜色不再变化
c.气压恒定时
③若反应在398K进行,某时刻测得n(NO2)=0.6 mol,n(N2O4)=1.2 mol,则此时v正____v逆(填“>”、“<”或“=”)。
(3)用氨气可设计成如图所示燃料电池,产生的X气体可直接排放到大气中。则a电极电极反应式为________________。
(4)t℃下,某研究人员测定NH3·H2O的电离常数为1.8×10-5。NH4+的水解常数为1.5×10-8,则该温度下水的离子积常数为___________,请判断t_____25℃(填“>”、“<”或“=”)。