六种短周期元素A、B、C、D、E、F的原子序数依次增大,其中A与E,B与F同主族,E与F同周期;D的核电荷数是F的最外层电子数的2倍;B的最高正价与最低负价的代数和为0;常温下单质A与E的状态不同。下列判断正确的是
A.A、D两种元素形成的化合物中只含有极性键
B.A、C、D三种元素形成的化合物一定是共价化合物,其溶液一定呈酸性
C.原子半径由大到小的顺序是F>E>C>D
D.最高价氧化物对应水化物酸性最强的元素是C
下列事实不能用化学平衡原理解释的是
| A.温度控制在500℃有利于合成氨反应 | B.用排饱和食盐水法收集Cl2 |
| C.打开碳酸饮料会有大量气泡冒出 | D.在硫酸工业生产中使用过量的氧气 |
关于平衡常数,下列说法不正确的是
| A.平衡常数随温度的改变而改变 |
| B.使用催化剂不能改变平衡常数 |
| C.平衡常数不随反应物或生成物浓度的改变而改变 |
| D.增大压强促使平衡向正反应方向进行,则平衡常数增大 |
恒容容器中反应:A(g)+3B(g) 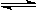 2C(g)+3D(g),达到平衡的标志是
2C(g)+3D(g),达到平衡的标志是
①体系的压强不再改变 ②混合气体的平均相对分子质量不再改变 ③各组分的浓度不再改变 ④混合气体的密度不变 ⑤反应速率vA: vB: vC: vD=1:3:2:3 ⑥单位时间内1 mol A断键反应,同时2 mol C也断键反应
| A.②③⑤⑥ | B.②③④⑤ | C.①④⑤⑥ | D.①②③⑥ |
对于A2+3B2 2C的反应来说,以下化学反应速率的表示中,反应速率最快的是
2C的反应来说,以下化学反应速率的表示中,反应速率最快的是
A.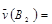 0.8mol·L-1·s-1 0.8mol·L-1·s-1 |
B.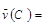 0.7mol·L-1·s-1 0.7mol·L-1·s-1 |
C. 0.4mol·L-1·s-1 0.4mol·L-1·s-1 |
D.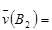 54mol·L-1·min-1 54mol·L-1·min-1 |
用惰性电极进行电解,下列说法正确的是
| A.电解稀硫酸溶液,实质上是电解水,故溶液pH不变 |
| B.电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小 |
| C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1∶2 |
| D.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1∶1 |