常温下某溶液中由水电离产生的c(H+)=1×10-9mol·L-1,则下列叙述正确的是
| A.pH值一定为5 | B.一定是酸溶液 |
| C.可能是强酸的酸式盐溶液 | D.pH值可能为9 |
关于下列各图的叙述,正确的是()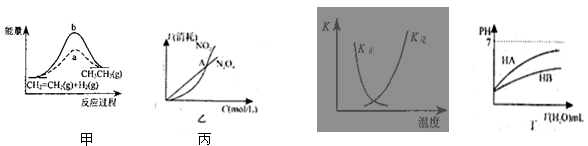
| A.图甲中a、b曲线分别表示反应CH2=CH2 (g) + H2(g)→CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化 |
B.图乙表示恒温恒容条件下发生的可逆反应2NO2(g)  N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 |
C.图丙中曲线表示反应2SO2(g) + O2(g)  2SO3(g);ΔH < 0 正、逆反应的平衡常数K 2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化 |
| D.图丁中起始时HA的物质的量浓度大于HB |
下列说法不正确的是()
A.已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为α,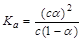 。若加入少量醋酸钠固体,则CH3COOH 。若加入少量醋酸钠固体,则CH3COOH CH3COO-+H+向左移动,α减小,Ka变小 CH3COO-+H+向左移动,α减小,Ka变小 |
B.常温下,反应 不能自发进行,则该反应的 不能自发进行,则该反应的 |
C.一定温度下,氯化铵水解离子方程式:NH+4+H2O NH3·H2O+H+,若用KW表示的离子积, NH3·H2O+H+,若用KW表示的离子积,Kb表示氨水电离常数,则氯化铵水解平衡常数K=KW/Kb |
| D.一种“人工固氮”的新方法是在光照条件下,N2茌催化剂表面与水蒸气发生反应生成NH3和氧气,己知: |

则“人工固氮”新方法的热化学方程式可表示为: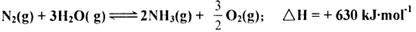
N2O5是一种新型硝化剂,在一定温度下可发生下列反应:2N2O5(g)  4NO2(g)+O2(g) ΔH > 0T1温度下的部分实验数据为:
4NO2(g)+O2(g) ΔH > 0T1温度下的部分实验数据为:
| t/s |
0 |
500 |
1000 |
1500 |
| c(N2O5)/mol·L-1 |
5.00 |
3.52 |
2.50 |
2.50 |
下列说法不正确的是()
A.500 s内N2O5分解速率为2.96×10-3 mol·(L·s)-1
B.T1温度下的平衡常数为K1=125, 1000 s时转化率为50%
C.其他条件不变时,T2温度下反应到1000 s时测得N2O5(g)浓度为2.98 mol·L-1,则T1<T2
D.T1温度下的平衡常数为K1,T3温度下的平衡常数为K3,若K1>K3,则T1>T3
已知aA+、bB2+、cC-、dD2-四种离子均具有相同的电子层结构,关于A、B、C、D四种元素的叙述正确的是()
A. 原子半径:A>B>C>D B. 原子序数:b>a>c>d
C. 离子半径:D>C>B>A D. 失电子能力:B>A,得电子能力:D>C
如图所示是元素周期表的一部分,X、Y、Z、W均为短周期元素,若w原子最外层电子数是其内层电子数的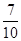 ,则下列说法中不正确的是()
,则下列说法中不正确的是()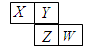
| A.最高价氧化物对应水化物的酸性:W > Z |
| B.Y元素的两种同素异形体在常温下都是气体 |
| C.原子半径由大到小排列顺序:Z >Y >X |
| D.气态氢化物的稳定性:Y > X |