非金属溴与氯气的性质很相似。在探究溴单质的性质时,其基本程序应该是( )
| A.做实验并观察实验现象→分析、解释,得出结论 |
| B.观察溴的外观性质→做实验并观察实验现象→分析、解释,得出结论 |
| C.观察溴的外观性质→预测溴的化学性质→实验并观察实验现象→分析、解释,得出结论 |
| D.预测溴的性质→做实验并观察实验现象→分析、解释,得出结论→观察溴的外观性质 |
下列说法中,不正确的是
| A.光导纤维的主要成分是二氧化硅 |
| B.NO2过量排放能引起酸雨和光化学烟雾 |
| C.核能、太阳能和天然气都属于新能源 |
| D.玻璃、水泥和陶瓷都属于传统硅酸盐材料 |
下列比较中,正确的是()
| A.同温度同物质的量浓度时,HF比HCN易电离,则NaF溶液的pH比NaCN溶液大 |
B.0.2 mol ·L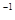 NH4Cl和0.1 mol·L NH4Cl和0.1 mol·L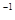 NaOH溶液等体积混合后:c(NH NaOH溶液等体积混合后:c(NH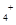 )>c(Cl )>c(Cl )>c(Na )>c(Na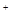 )>c(OH )>c(OH )>c(H )>c(H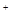 ) ) |
C.同浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3·H2O;c(NH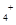 )由大到小的顺序是:①>②>③>④ )由大到小的顺序是:①>②>③>④ |
D.物质的量浓度相等的H2S和NaHS混合溶液中:c(Na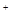 )+c(H )+c(H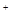 )=c(S )=c(S )+c(HS )+c(HS )+c(OH )+c(OH ) ) |
在室温条件下,向含有H2SO4的CuSO4溶液中逐滴加入含a mol溶质的NaOH溶液,恰好使溶液的pH=7,下列叙述正确的是()
| A.溶液中2c(Na+)=c(SO42-) | B.0<沉淀的物质的量<a/2 mol |
| C.沉淀的物质的量a/2 mol | D.原溶液中c(H2SO4) =" a/2" mol/L |
下列有关热化学方程式的叙述正确的是()
| A.已知2H2O(l)=2H2(g)+O2(g)△H=+571.6 kJ·mol—1,则氢气燃烧热为285.8 kJ·mol— |
| B.已知C(石墨,s)=C(金刚石,s) △H>0,则金刚石比石墨稳定 |
| C.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l) △H=-57.4 kJ·mol—1 |
| D.己知2C(s)+2O2(g)=2CO2(g) △H1;2C(s)+O2(g)=2CO(g) △H2,则△H1>△H2 |
工业用CaO和硝酸反应制Ca(NO3)2·4H2O晶体,为确保制备过程既不补充水分,又无水剩余,则应选用的硝酸质量分数()
| A.30% | B.63% | C.70% | D.84% |