取pH均等于2的盐酸和醋酸各100mL分别稀释2倍后,再分别加入0.03g锌粉,在相同条件下充分反应,有关叙述正确的是
| A.盐酸和醋酸分别与锌反应放出的氢气一样多 |
| B.醋酸与锌反应放出氢气多 |
| C.盐酸与锌反应速率大 |
| D.盐酸和醋酸分别与锌反应的速率一样大 |
高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。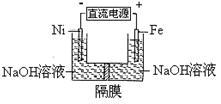
下列推断合理的是
| A.铁是阳极,电极反应为Fe-6e-+4H2O=FeO42-+ 8H+ |
| B.电解时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极 |
| C.若隔膜为阴离子交换膜,则OH-自右向左移动 |
| D.电解时阳极区pH降低、阴极区pH升高,撤去隔膜混合后,与原溶液比较pH降低(假设电解前后体积变化忽略不计) |
下列说法不正确的
A.某有机物含有C、H、O、N四种元素,其球棍模型为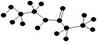 ;该有机物的结构简式为
;该有机物的结构简式为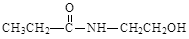
B.此分子中至少有10个碳原子处于同一平面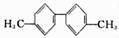
C.某烃的分子式为C10H14,它不能使溴水褪色,但可使酸性KMnO4溶液褪色,且分子结构中只有一个烷基,符合条件的烃有4种
D.目前,世界上已合成了几百种有机超导体, TCNQ是其中之一。TCNQ的分子结构如图所示。可知1mol TCNQ在一定条件下最多可跟12mol H2反应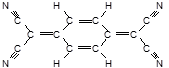
X、Y、Z、W为四种短周期元素。X原子最外层电子数是核外电子层数的3倍;Y的单质在通常状况下是黄绿色的气体;Z在地壳中的含量仅次于氧;Y、Z、W同周期,W的常见化合价为+2。下列说法正确的是
| A.原子半径:Y>Z>W>X |
| B.存放W单质的仓库失火可用泡沫灭火器灭火 |
| C.Z的氧化物通常形成分子晶体,分子内含有共价键 |
| D.Y的单质能把溴从溴化物中置换出来 |
下列物质的检验,其结论一定正确的是
| A.向某溶液中加入BaCl2溶液,产生白色沉淀,加入HNO3后,白色沉淀不溶解,也无其他现象,说明原溶液中一定含有SO42- |
| B.向某溶液中加盐酸产生无色气体,该气体能使澄清的石灰水变浑浊,说明该溶液中一定含有CO32- 或SO32- |
| C.取少量久置的Na2SO3样品于试管中加水溶解,再加盐酸酸化,然后加BaCl2溶液,若加HCl时有气体产生,加BaCl2时有白色沉淀产生,说明Na2SO3样品已部分被氧化 |
| D.能使湿润的碘化钾淀粉试纸变蓝的一定是Cl2 |
下列说法正确的是
| A.瑞典化学家阿累尼乌斯提出了酸碱质子理论,扩大了人们对酸碱的认识 |
| B.活泼金属元素的氧化物一定是碱性氧化物,非金属元素的氧化物一定是酸性氧化物 |
| C.使用太阳能热水器、沼气利用、玉米制乙醇等都涉及到生物质能的利用 |
| D.中国是目前全球最大的稀土提炼和加工国,对稀土元素及其化合物的研究是获得优良催化剂的一种重要途径 |