科学家设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示。下列说法不正确的是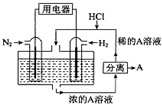
| A.通入N2的电极发生的电极反应式为:N2+6e-+8H+=2NH4+ |
| B.反应过程中溶液的pH会变大,故需要加入盐酸 |
| C.该电池外电路电流从通入H2的电极流向通入N2的电极 |
| D.通入H2的电极为负极,A为NH4Cl |
乙醇分子中不同的化学键如图:关于乙醇在各种反应中断裂键的说明不正确的是()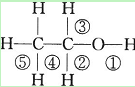
| A.乙醇和钠反应键①断裂 |
| B.在Ag催化下和O2反应键①③断裂 |
| C.乙醇和浓H2SO4共热140℃时,键①或键②断裂; 在170℃时键②⑤断裂 |
| D.乙醇完全燃烧时裂键①② |
能在有机物的分子中引入羟基官能团的反应类型有:①酯化反应②取代反应③消去反应④加成反应⑤水解反应。其中正确的组合有()
| A.①②③ | B.④⑤ | C.②④⑤ | D.②③④⑤ |
能在有机物的分子中引入羟基官能团的反应类型有:①酯化反应②取代反应③消去反应④加成反应⑤水解反应。其中正确的组合有()
| A.①②③ | B.④⑤ | C.②④⑤ | D.②③④⑤ |
某烃的衍生物分子式可写为(CH2)m(CO2)n(H2O)p。当它完全燃烧时,生成的CO2与消耗的O2在同温同压下体积比为1:1,则m:n为()
| A.2:1 | B.2:3 | C.1:1 | D.1:2 |
A、B、C三种醇同足量的金属钠反应,在相同条件下产生相同体积的氢气,消耗这三种醇的物质的量之比为2∶6∶3,则A、B、C三种醇分子中羟基数之比是( )
A. 3∶2∶1 B. 2∶6∶3 C. 3∶1∶2 D. 2∶1∶3