(有机物A可用葡萄发西酵得到,也可从牛奶中提取,纯净的A为无色粘稠液体,易溶于水,为研究A的组成与结构,进行如下实验:
| 实 验 步 骤 |
解 释 或 实 验 结 论 |
| (1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍. |
试通过计算填空: (1)A的相对分子质量为:___________ |
| (2)将此9.0g A在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现分别增重5.4g和13.2g. |
(2)A的分子式为:___________ ____________ |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24L CO2(标准状况),若与足量金属钠反应则生成2.24L H2(标准状况). |
(3)写出A中所含有的官能团名称:________________ |
(4)A的核磁共振氢谱如图: |
(4)A中含有_____种氢原子. |
| (5)综上所述,A的结构简式___________________ |
实验室用18.4 mol·L-1的浓硫酸来配制500mL 0.2 mol·L-1的稀硫酸。
(1)所需仪器除了玻璃棒、烧杯、胶头滴管 、量筒外,还需要哪个仪器才能完成该实验,请写出:。
(2)计算所需浓硫酸的体积为________ mL 。现有①10mL ②50mL ③100mL三种规格的量筒,应当选用___________。(填序号)
(3)实验中两次用到玻璃棒,其作用分别是:___________、__________。
(4)下列对容量瓶及其使用方法的描述中正确的是_____。
| A.容量瓶上标有容积、温度和浓度 |
| B.容量瓶用蒸馏水洗净后,必须烘干 |
| C.配制溶液时,把量好的浓硫酸小心倒入容量瓶中,加入蒸馏水到接近刻度线 1~2 cm处,改用胶头滴管加蒸馏水至刻度线 |
| D.使用前要检查容量瓶是否漏水 |
(5)在配制过程中,下列操作可引起所配溶液浓度偏低的有_______。(填序号)
①未洗涤稀释浓硫酸时用过的烧杯和玻璃棒。
②未等稀释后的硫酸溶液冷却至室温就转移到容量瓶中。
③转移前,容量瓶中含有少量蒸馏水。
④定容时,仰视刻度线。
1-乙氧基萘是一种无色液体,密度比水大,不溶于水,易溶于醇、醚,熔点5.5 ℃,沸点267.4 ℃。1-乙氧基萘常用作香料,也可作为合成其他香料的原料。实验室制备1-乙氧基萘的过程如下: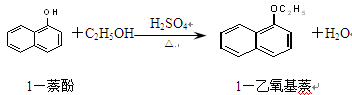
(1)将混合液置于如图所示的容器中加热充分反应。实验中使用过量乙醇的原因是。烧瓶上连接长直玻璃管的主要作用是。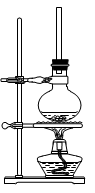
(2)反应结束,将烧瓶中的液体倒入冷水中,经处理得到有机层。为提纯产物有以下四步操作:①蒸馏②水洗并分液③用10%的NaOH溶液碱洗并分液④用无水氯化钙干燥并过滤。正确的顺序是。
A.③②④①B.①②③④ C.②①③④
(3)蒸馏时所用的玻璃仪器除了酒精灯、冷凝管、接收器、锥形瓶外还有。
(4)实验测得1-乙氧基萘的产量与反应时间、温度的变化如图所示,时间延长、温度升高1-乙氧基萘的产量下降的原因可能是、。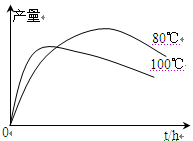
(5)用金属钠可检验1-乙氧基萘是否纯净,简述实验现象与结论:。
依据氧化还原反应:2Fe3+(aq) + Fe(s) ="=" 3Fe2+(aq),设计原电池并完成如图所示实验。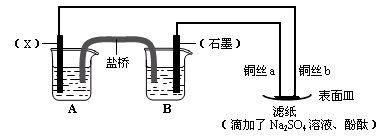
请回答下列问题:
⑴电极X的材料是;石墨电极为电池的 极。
极。
⑵B装置中发生的电极反应方程式为;表面皿中溶质Na2SO4的作用是。
⑶铜丝b与滤纸接触处的现象为;此处电极反应方程式为:。
下列方法中,能用于实验室制取氨的是
①在烧瓶中将熟石灰和氯化铵混合,加水调成泥状后加热
②加热试管中的氯化铵固体
③将烧瓶中的浓氨水加热
④将分液漏斗中的浓氨水滴入装有生石灰的烧瓶中
合金已成为飞机制造、化工生产等行业的重要材料。研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究。填写下列空白。
〖实验方案一〗将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。实验中发生反应的化学方程式是
〖实验步骤〗
(1)称取5.4 g铝镁合金粉末样品,溶于VmL 2.0 mol/LNaOH溶液中,充分反应。则NaOH溶液的体积V ≥ 。
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将
(填“偏高”、“偏低”或“无影响”)。
〖实验方案二〗将铝镁合金与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃,1.01×105Pa)的体积。
〖问题讨论〗
(3)同学们拟选用下列实验装置完成实验: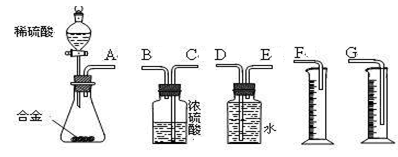
①你认为最简易的装置其连接顺序是(填接口字母,可不填满):
A接( )( )接( )( )接( )
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶。请你帮助分析原因。 。
③实验结束时,在读取测量实验中生成氢气的体积时,你认为合理的是 。
| A.待实验装置冷却后再读数 |
| B.上下移动量筒F,使其中液面与广口瓶中液面相平 |
| C.上下移动量筒G,使其中液面与广口瓶中液面相平 |
| D.视线与凹液面的最低点水平,读取量筒中水的体积 |