在标准状况下充满HCl的烧瓶做完喷泉实验后得到稀盐酸,用标准碳酸钠溶液滴定这种盐酸测定它的准确浓度,请你回答下列问题:
(1)用标准Na2CO3溶液滴定这种盐酸时,Na2CO3溶液应装在___________式滴定管中,若用甲基橙作指示剂,达到滴定终点时,溶液从___________色变为___________色。
(2)现配制三种浓度的标准Na2CO3溶液,你认为最合适的是下列第___________种(填序号)。
①2.500 mol·L-1 ②0.25 mol·L-1 ③0.025 mol·L-1
(3)若采用上述合适浓度的标准Na2CO3溶液滴定,用c(Na2CO3)表示,滴定时实验数据列表如下:
| 实验编号 |
待测盐酸体积(mL) |
滴入Na2CO3溶液体积(mL) |
| 1 |
20.00 |
18.80 |
| 2 |
20.00 |
16.95 |
| 3 |
20.00 |
17.05 |
求这种待测稀盐酸的物质的量浓度(用数据和符号列式即可):c(HCl)=________。
(4)用A.偏高;B.偏低;C.无影响;D.无法判断,填写下列各项操作会给实验造成的误差。
①开始滴定时,滴定管尖端处有气泡,滴定完毕气泡排出( )
②滴定前读数时仰视,滴定完毕读数时俯视( )
(11分) 甲、乙、丙、丁四种单质在点燃条件下两两化合生成X、Y、Z、W四种化合物,转化关系如右图所示。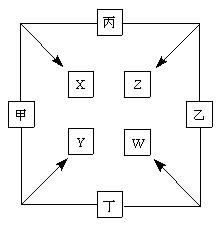
已知:
①甲、乙、丙均为前三周期元素的单质,常温下均为气体,丁是日常生活中的一种常见金属。
②常温下,X是无色液体,Y是黑色固体。
③丙在乙中燃烧发出苍白色的 火焰,W的水溶液呈黄色。
火焰,W的水溶液呈黄色。
请回答:
(1)写化学式:甲_____________, Z_____________。
(2)丁与X在高温下也能得到Y,请写出该反应的化学方程式
___________________________________________________。
(3)将少量W的溶液滴入几滴KSCN溶液,迅速变为红色,请写出该反应的化学方程式____________________________________________________。
(4)甲与丙两单质的元素可形成原子个数比1∶1的化合物H,将H滴入品红后,溶液的颜色逐渐褪去,加热后溶液为(填颜色)。
(5)将Y恰好溶于Z的水溶液后,检验其中低价金属离子的方法是滴入酸性KMnO4,紫色褪去,说明有该离子,仔细分析后发现该结论存在缺陷,此“缺陷”是。
[化学—选修有机化学基础]
乙基香兰素是当今世界上最重要的合成香料之一,其结构简式如图所示。
(1)下列关于乙基香兰素的推测中正确的是(填字母)。
a.从分子结构上看,它属于芳香烃 b.该物质的一个分子内含有一个碳氧双键、三个碳碳双键
c.1mol该物质最多能与4molH2发生加成反应 d.该物质能与碳酸钠溶液反应产生CO2气体
(2)R物质属于乙基香兰素的同分异构体,其性质如下:
试写出符合条件的R的结构简式(任写两种):、。
(3)X也是乙基香兰素的同分异构体,其可以通过不同的反应制得下列物质。
请回答下列问题:
①反应Ⅰ的反应类型是。
②反应Ⅲ所需的试剂是。
③反应Ⅳ的化学方程式为。
[化学—选修物质结构与性质]
研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题:
(1)C、Si、N元素的电负性由大到小的顺序是。C60和金刚石都是碳的同素异形体,二者比较熔点高的是,原因是。
(2)A、B均为短周期金属元素,依据下表数据,写出B的基态原子的电子排布式。
| 电离能(kJ/mol) |
I1 |
I2 |
I3 |
I4 |
| A |
932 |
1821 |
15390 |
21771 |
| B |
738 |
1451 |
7733 |
10540 |
(3)过度金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般地,为d0或d10排布时,无颜色,为d1~d9排布时,有颜色。如[Co(H2O)6]2+显粉红色。据此判断,[Mn(H2O)6]2+(填“无”或“有”)颜色。
(4)利用CO可以合成化工原料COCl2、配合物Fe(CO)5等。
①COCl2分子的结构式为 ,每个COCl2分子内含有个σ键,个π键。其中心原子采取杂化轨道方式。
,每个COCl2分子内含有个σ键,个π键。其中心原子采取杂化轨道方式。
②Fe(CO)5在一定条件下发生分解反应:Fe(CO)5(s)=Fe(s)+5CO(g),反应过程中,断裂的化学键只有配位键,则形成的化学键类型是。
[化学—选修化学与技术]
工业上常用氨氧化法生产硝酸,其生产过程包括氨的催化氧化(催化剂为铂铑合金丝网)、一氧化氮的氧化和水吸收二氧化氮生成硝酸。请回答下列问题:
⑴氨催化氧化反应在一定温度下(水为气体)为正反应放热的可逆反应,写出该反应的化学方程式和平衡常数表达式K=,若升高温度,则K的值(填“增大”“减小”或“不变”)。
⑵为了提高NH3的转化率,可以采取。
a.减小压强b.增大反应物浓度c.使用催化剂d.降低温度e.及时分离出NH3
⑶原料气中空气必须过量,其主要原因是。
⑷将铂铑合金做成薄丝网的主要原因是。
⑸水吸收二氧化氮生成硝酸为放热反应,其化学方程式为,
为了提高水对二氧化氮的吸收率,可采取的措施为(答2项)。
有M、A、B、D、E五种短周期元素,其原子序数依次增大,M元素的原子半径是周期表所有元素中最小的。A、B、D、E分别在下表中(周期表的一部分)不同的空格内占有相应的位置,它们的原子序数之和为37。请回答:
(1)元素符号:ABDE
(2)D、E两种元素分别与M元素形成的最简单化合物中,相对稳定的是(填化学式),沸点较高的是(填化学式)。
(3)A、B、D、M可组成多种18电子的分子,其中的两种结构可分别表示为M2B—BM2和
AM3—BM2,请再写出2种具有18电子的有机物的结构简式、。
(4)M、B、D以原子个数比4:2:3所形成的离子化合物,其水溶液呈性。0.1mol/L该化合物的水溶液中各离子的浓度由大到小的排序是。