铁和铜是生活中两种常见的金属材料,某同学查阅资料得知铁主要是由铁矿石经热还原的方法冶炼的,常见的铁矿石有磁铁矿、赤铁矿、黄铁矿(主要成分为FeS2)等。
(1)赤铁矿的主要成分为__________(填化学式),工业上用一氧化碳还原赤铁矿冶炼铁的化学反应方程式为________________;
(2)从矿物资料查得,一定条件下自然界存在如下反应:
14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4;(已知FeS2中Fe显+2价)
该反应中氧化剂是_____(填化学式),当有5molFeS2发生反应时,电子转移数为________;
(3)印刷电路板是由高分子材料和铜箔复合而成,刻制印刷电路时,用FeCl3溶液作“腐蚀液”,请写出刻制过程的离子方程式__________________。
(2014)不饱和酯类化合物在药物、涂料等领域应用广泛。
(1)下列关于化合物I的说法,正确的是
| A.与FeCl3溶液可能显紫色 |
| B.可能发生酯化反应和银镜反应 |
| C.能与溴发生取代和加成反应 |
| D.1mol化合物I最多与2molNaOH反应 |
(2)反应①的一种由烯烃直接制备不饱和酯的新方法
化合物II的分子式为 。1mol化合物II能与 molH2恰好反应生成饱和烃类化合物。
(3)化合物II可由芳香族化合物III或IV分别通过消去反应获得。但只有III能与Na反应产生H2。III的结构简式为 (写1种);由IV生成II的反应条件为 。
(4)聚合物
可用于制备涂料。其单体的结构简式为 。利用类似反应①的方法仅以乙烯为有机原料合成该单体,涉及的反应方程式为 。
白酒产品中的塑化剂主要源于塑料接酒桶、塑料输酒管、成品酒塑料内盖等。DBP是塑化剂的一种,可由下列路线合成:
已知以下信息:
(1)A的结构简式是________,D的结构简式是________,D→E的反应类型是________。
(2)D和H2l:l反应生成E,则E官能团名称为________,DBP的分子式为________。
(3)由B和E以物质的量比1:2合成DBP的化学方程式为____________。
(4)写出同时符合下列条件的B的所有同分异构体的结构简式____________。
①能和NaHCO3溶液反应生成CO2
③能使FeCl3溶液发生显色反应
②能发生银镜反应
④苯环上含碳基团处于对位
(5)写出B与碳酸氢钠溶液反应的化学方程式________。
写出C生成D的反应的化学方程式_____ ___。
根据下列信息回答问题。
(1)请用系统命名法对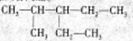 ,命名:_____________;
,命名:_____________;
(2)HO(CH2)3COOH发生缩聚反应后所得缩聚物的结构结构简式:____________;
(3)一定条件下某烃M与H2按物质的量之比1:2加成生成C2H5C(CH3)3,则烃M的结构简式为_____________.
I.NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题: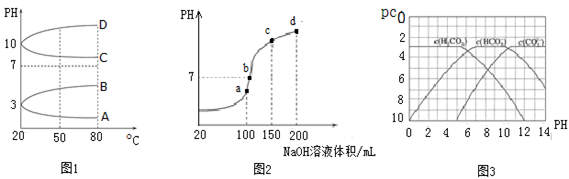
(1)相同条件下,0.1 mol·L-1NH4Al(SO4)2中c(NH4+) (填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH4+)。
(2)如图1是0.1 mol·L-1电解质溶液的pH随温度变化的图像。
①其中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是 (填写字母);
②20℃时,0.1 mol·L-1NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)= mol·L-1(填数值)。
(3)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示。
试分析图中a、b、c、d四个点,水的电离程度最大的是 ;在b点,溶液中各离子浓度由大到小的排列顺序是 。
II.pC是指极稀溶液中溶质物质的量浓度的常用对数负值,类似pH。如某溶液溶质的浓度为1×10-3 mol·L-1,则该溶液中该溶质的pC=-lg10-3=3。已知H2CO3溶液中存在下列平衡:CO2+H2O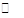 H2CO3 H2CO3
H2CO3 H2CO3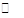 H++HCO3- HCO3-
H++HCO3- HCO3-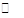 H++CO32-
H++CO32-
图3为H2CO3、HCO3-、CO32-在加入强酸或强碱溶液后,达到平衡时溶液中三种成分的pCpH图。请回答下列问题:
(1)在pH=9时,H2CO3溶液中浓度最大的含碳元素的离子为 。
(2)pH<4时,溶液中H2CO3的pC总是约等于3的原因是 。
(3)已知M2CO3为难溶物,则其Ksp的表达式为 ;现欲将某溶液中的M+以碳酸盐(Ksp=)的形式沉淀完全,则最后溶液中的CO32-的pC最大值为 (溶液中的离子浓度小于1×10-5 mol·L-1时,沉淀完全)。
(1)硫酸是重要的化工材料,二氧化硫生成三氧化硫是工业制硫酸的重要反应之一。2SO2(气)+ O2 (气)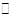 2SO3(气)△H<0。
2SO3(气)△H<0。
根据化学平衡原理来确定的条件或措施有 (填序号)。
A.为提高SO2的转化率,加入过量的空气
B.含SO2的炉气在进行氧化反应以前必须净化,其目的就是为了除尘、以防催化剂中毒
C.使用作V2O5催化剂
D.反应条件不使用很高温度
E.氧化反应在常压下进行
(2)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如下图所示。根据图示回答下列问题: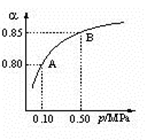
①将2 mol SO2和1 mol O2置于10L密闭容器中,反应达到平衡后,体系的总压为0.10MpPa,该反应的平衡常数为 。
②平衡状态由A变到B时,平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(3)若实验室在催化剂存在的条件下,向某密闭容器中充入1.6molSO2和0.8molO2,此时容器体积为100L,在温度和压强不变条件下反应达到平衡,SO3体积分数为0.50,SO2的转化率为α。
①达平衡时混合气体的体积为_________,α为_________;
②若保持温度和压强不变,平衡时再充入1 molSO3,则平衡时SO2体积分数为 ;
③若起始时充入x mol SO2、y molO2和z mol SO3,在,反应达平衡时,测得混合气体的体积为120 L,SO3体积分数仍为0.5。则x、 y应满足的关系式为 ,x、z应满足的关系式为 。
④在同样的温度下,若条件为恒温恒容(100L),在此容器中加入1.6molSO2和0.8molO2到达平衡时,SO2的转化率_______α(填“大于”、“小于”或“等于”)
(4)硫酸工业的尾气中含有少量的SO2,常用氨水吸收后在加硫酸,回收SO2同时得到化肥硫酸铵,硫酸铵溶液中各离子物质的量浓度由大到小的顺序为 。