(2014)不饱和酯类化合物在药物、涂料等领域应用广泛。
(1)下列关于化合物I的说法,正确的是

| A.与FeCl3溶液可能显紫色 |
| B.可能发生酯化反应和银镜反应 |
| C.能与溴发生取代和加成反应 |
| D.1mol化合物I最多与2molNaOH反应 |
(2)反应①的一种由烯烃直接制备不饱和酯的新方法

化合物II的分子式为 。1mol化合物II能与 molH2恰好反应生成饱和烃类化合物。
(3)化合物II可由芳香族化合物III或IV分别通过消去反应获得。但只有III能与Na反应产生H2。III的结构简式为 (写1种);由IV生成II的反应条件为 。
(4)聚合物

可用于制备涂料。其单体的结构简式为 。利用类似反应①的方法仅以乙烯为有机原料合成该单体,涉及的反应方程式为 。
A、B、C三个烧杯中分别盛有200mL相同物质的量浓度的 稀硫酸
稀硫酸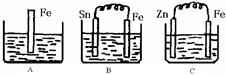
(1)分别写出三个装置中铁片表面发生反应的离子方程式:
A;B;C。
(2)一段时间后,B中Sn极附近溶液的pH(填“增大”、“减小”、“不变”)。
(3)一段时间后,C中产生了3.36L(标准状况)气体时,硫酸恰好全部被消耗,则原稀硫酸溶液的物质的量浓度= mol·L-1。此时,三个烧杯中液体质量由大到小的顺序为:(填写序号) 。
(4)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是(填写序号)。
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:
(1)该反应的化学方程式为。
(2)反应开始至2min,以气体Z表示的平均反应速率为。
(3)若X、Y、Z均为气体,2min后反应达到平衡,反应达平衡时:
①此时体系的压强是开始时的倍;
②达平衡时,容器内混合气体的平均相对分子质量比起始投料时 ____________(填“增大”“减小”或“相等”)。
A、B、C、D都是短周期元素,原子半径D>C>A>B。其中A、B处于同一周期,A、C处于同一主族。C原子核内的质子数等于A、B原子核内质子
 数之和,C原子最外层电子数是D原子最外层电子数的4倍。
数之和,C原子最外层电子数是D原子最外层电子数的4倍。 19
19
(1)写出C元素在周期表的位置:第周期族
(2)画出元素D的离子结构示意图:。B存在同素异形现象,其中常用作消毒剂的是。(填化学式)
(3)这四种元素中的非金属气态氢化物的稳定性由大到小的顺序:(填化学式)
(4)A与B形成的三原子分子的结构式:,B与D形成的原子个数比为1:1的化合物的电子式:。
(5)C的氧化物和D的最高价氧化物对应水化物反应的离子方程式为:。
工业上一般在恒容密闭容器中用H2和CO生产燃料甲醇,反应方程式为
CO(g)+2H2(g) CH3OH(g)△H
CH3OH(g)△H
(1)下表所列数据是反应在不同温度下的化学平衡常数(K)。
| 温度 |
250°C |
300°C |
350°C |
| K |
2.041 |
0.270 |
0.012 |
①由表中数据判断△H0(填“>”、“=”或“<“)
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为,此时的温度为。
(2)在100℃ 压强为0.1 MPa条件下,容积为V L某密闭容器中a mol CO与 2amol H2在催化剂作用下反应生成甲醇,达平衡时CO的转化率为50%,则100℃该反应的的平衡常数K=(用含a、V的代数式表示并化简至最简单的形式)。此时保持温度容积不变,再向容器中充入a mol CH3OH(g),平衡_____(向正反应方向、向逆反应方向)移动,再次达到新平衡时,CO的体积分数。(减小、增大、不变)
(3)要提高CO的转化率,可以采取的措施是。
A.升温 B.加入催化剂 C.增加CO的浓度
D.恒容充入H2 E.恒压充入惰性气体 F.分离出甲醇
(4)判断反应达到平衡状态的依据是(填字母序号,下同)。
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的相对平均分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
(5)300°C,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡的有关数据如下:
| 容器 |
甲 |
乙 |
丙 |
|
| 反应物投入量 |
1molCO、2moL H2 |
1molCH3OH |
2molCH3OH |
|
| 平 衡 时 的 数 据 |
CH3OH浓度(mol/L) |
c1 |
c2 |
c3 |
| 反应的能量变化 |
akJ |
bkJ |
ckJ |
|
| 体系压强(Pa) |
p1 |
p2 |
p3 |
|
| 反应物转化率 |
α1 |
α2 |
α3 |
请选择正确的序号填空(不定项选择)
(1)c1、c2、c3的关系表达正确的为______
A c3>2c1 B c1<c3<2c1 C c1=c2
(2)a、b、c的关系表达正确的为________
A c<2|△H| B a+b=|△H|C c=2b
(3)p1、p2、p3的关系不正确的为________
A p1=p2 B p2<p3<2p2C p3>2p2
(4)a1、a2、a3的关系表达不正确的为________
A a1=a2 B a3< a2C a1+a2=1
Ⅰ某温度下,密闭容器中充入1 mol N2和3 mol H2,使之反应合成NH3,平衡后,测得NH3的体积分数为w,如果温度不变,只改变起始加入量,使之反应平衡后NH3的体积分数仍为w,N2、H2、NH3的物质的量分别用x、y、z表示.
(1)恒温恒容条件下:若x=0.75 mol, 则y=________,z=________.
(2)恒温恒压条件下,x、y、z(均不小于0)满足的一般条件是_______________________.
Ⅱ一定条件下,可逆反应X(g)+Y(g) 2Z(g)达到平衡时,各物质的平衡浓度为c(X)=0.5mol/L;c(Y) ="0.1" mol /L ; c (Z)="1.6" mol /L若用a、b、c 分别表示X Y Z的初始浓度(mol/L)则a、b应满足的关系是____________, a的取值范围为_______________
2Z(g)达到平衡时,各物质的平衡浓度为c(X)=0.5mol/L;c(Y) ="0.1" mol /L ; c (Z)="1.6" mol /L若用a、b、c 分别表示X Y Z的初始浓度(mol/L)则a、b应满足的关系是____________, a的取值范围为_______________
Ⅲ在10℃和4×105Pa的条件下,当反应aA(g) dD(g)+eE(g),建立平衡后,维持温度不变而压强改变,测得D的浓度变化如下:
dD(g)+eE(g),建立平衡后,维持温度不变而压强改变,测得D的浓度变化如下:
| 压强(Pa) |
4×105 |
6×105 |
10×105 |
20×105 |
| D的浓度(mol/L) |
0.085 |
0.126 |
0.200 |
0.440 |
(1)压强从4×105Pa增加到6×105Pa时,平衡向(填“正”或“逆”)方向移动,理由是_________________________________________________________________
(2)压强从10×105Pa增加到20×105Pa时,平衡向_______(填“正”或“逆”)方向移动