已知铁生锈的过程为:Fe → Fe(OH)2 → Fe(OH)3 → Fe2O3·xH2O。又知草酸(H2C2O4)分解的化学方程式为:H2C2O4 CO↑ + CO2↑ + H2O。某化学小组为测定两种不同生锈铁片的组成(设只含有铁和Fe2O3·xH2O),进行了以下探究,请你参与并完成对有关问题的解答。
CO↑ + CO2↑ + H2O。某化学小组为测定两种不同生锈铁片的组成(设只含有铁和Fe2O3·xH2O),进行了以下探究,请你参与并完成对有关问题的解答。
(1)甲同学利用草酸分解产生的混合气体和下图所示装置测定其中一种锈铁的组成。

主要操作为:取锈铁样品12.6 g置于装置C的硬质玻璃管中,加热完全反应后得到固体的质量为8.4 g,装置D增重8.4 g。
①装置A的作用是 。装置B的作用是 。
②根据以上数据能否测定出锈铁的组成?答: (填“能”或“不能”)。
③该装置还存在的一个明显的缺陷是 。
(2)乙同学将生锈铁片溶于过量稀硫酸,检验所得溶液中是否存在Fe2+的实验操作方法是 。
(3)乙同学在甲同学装置的基础上将装置D换成装浓硫酸的洗气瓶(装置E,此装置图略),经改进后,重新按甲同学的操作和样品取用量进行实验,若完全反应后得到固体的质量仍为8.4 g,而装置E增重1.8 g,则x = ;m(Fe)︰m (Fe2O3·xH2O) = 。
A、B、C、D四种元素原子核电荷数依次增大(均小于20),其单质及相应的化合物能发生如下反应关系:
 |
1.写出B、D形成化合物电子式__________________。
2.写出下列有关物质化学式:E ___________, J _____________。
3.写出C单质与H水溶液反应的离子方程式___________________。
今有H2、Cl2混合气体100 mL(标准状况),其中一种气体体积为45 mL,另一种气体为55 mL,光照使两种气体发生反应后,恢复到标准状态,气体体积为______mL。为了证明反应后气体中H2和Cl2有剩余,使气体通过10 mL水,并使剩余气体干燥后恢复到标准状态,若
(1)剩余__________mL气体,证明有__________剩余,理由是____________________。
(2)溶液有__________性质,证明有__________剩余,理由是____________________。
在已经提取氯化钠、溴、镁等化学物质的富碘卤水中,采用下列工艺流程生产单质碘。完成下列问题: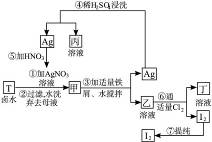
(1)写出乙、丁中溶质的化学式:乙___________,丁___________。
(2)第④步操作中用稀硫酸浸洗的目的是___________。
a.除去未反应的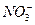
b.除去未反应的I-
c.除去未反应的Fe
d.除去碱性物质
(3)第⑦步操作可供提纯I2的两种方法是___________和___________(不要求写具体步骤)。
(4)实验室检验I2的方法是_________________________________。
(5)甲物质见光易变黑,其原因是(用化学方程式表示):______________________。
(提示:3Ag+4HNO3====3AgNO3+NO↑+2H2O)
(6)按上述实验过程填空: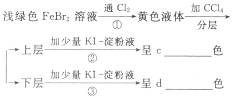
写出①②③反应的化学方程式。
①____________________________________________________________________;
②____________________________________________________________________;
③____________________________________________________________________。
已知I2+H2S====2HI+S。把Cl2缓慢通入到一含有I-、Br-、S2-(三者浓度相同)的溶液中,首先析出的是_________,最后析出的是_________。
(2)取2 g铝粉和3 g碘小心混匀,均分为四份。分别加0.5 g水,1 g胆矾,1 g无水硫酸铜,1 g明矾。加水的一份首先冒火花,发生剧烈反应,其次是加明矾的一份,而加无水硫酸铜的难发生反应。
①铝和碘发生反应的化学方程式为___________________________。
②铝和碘反应看到的现象是____________________________________。
③四份混合物发生反应的先后顺序说明:
a. ______________________________________________________,
b. ______________________________________________________。
向含有等物质的量的NaCl和NaBr的混合溶液中通入足量的氯气,反应完全后,将溶液蒸发至干,可得固体物质58.5 g,则原混合溶液中含Na+_______mol,含NaBr________g。