下列关于电解质溶液的叙述正确的是
| A.室温下,将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+) |
| B.室温下,pH=3的氢氟酸加水稀释后,溶液pH减小 |
| C.室温下,pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 |
D.向0.1mol/L的氨水中加入少量硫酸铵固体,则溶液中 增大 增大 |
在一定温度下的定容密闭容器中,下列情况能表明可逆反应:H2(g)+I2(g)  2HI(g)已达平衡的是
2HI(g)已达平衡的是
| A.H2的生成速率与I2的生成速率相等 |
| B.若单位时间内生成n mol H2的同时生成2n mol HI |
| C.H2、I2、HI的浓度相等 |
| D.反应容器内的压强不随时间的变化而变化 |
已知:Fe2O3(s) +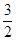 C(s)=
C(s)=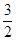 CO2(g) +2Fe(s) ΔH1="+234.1" kJ·mol-1,C(s)+ O2(g)=CO2(g) ΔΗ2="-393.5" kJ·mol-1,则2Fe(s) +
CO2(g) +2Fe(s) ΔH1="+234.1" kJ·mol-1,C(s)+ O2(g)=CO2(g) ΔΗ2="-393.5" kJ·mol-1,则2Fe(s) +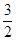 O2(g) =Fe2O3(s) 的ΔH是
O2(g) =Fe2O3(s) 的ΔH是
| A.-824.4 kJ·mol-1 |
| B.-627.6 kJ·mol-1 |
| C.-744.7 kJ·mol-1 |
| D.-169.4 kJ·mol-1 |
将1 mol H2(g)和2 mol I2(g)置于某2 L密闭容器中,在一定温度下发生反应:H2(g)+I2(g)  2HI(g)ΔH<0,并达到平衡,HI的体积分数w(HI)随时间(t)变化如图(Ⅱ)所 示。若改变反应条件,w(HI)的变化曲线如图(Ⅰ)所示,则改变的条件可能是
2HI(g)ΔH<0,并达到平衡,HI的体积分数w(HI)随时间(t)变化如图(Ⅱ)所 示。若改变反应条件,w(HI)的变化曲线如图(Ⅰ)所示,则改变的条件可能是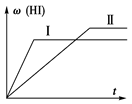
| A.恒温恒容条件下,加入适当催化剂 |
| B.恒温条件下,缩小反应容器体积 |
| C.恒容条件下,升高温度 |
| D.恒温条件下,扩大反应容器体积 |
在25 ℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
| 物质 |
X |
Y |
Z |
| 初始浓度/mol·L-1 |
0.1 |
0.2 |
0 |
| 平衡浓度/mol·L-1 |
0.05 |
0.05 |
0.1 |
下列说法错误的是
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y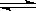 2Z,其平衡常数为1600(mol/L) -2
2Z,其平衡常数为1600(mol/L) -2
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
在一密闭容器中,反应aA(气)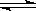 bB(气)达到平衡后,保持温度不变,将容器体积增大一倍,当达到新平衡时,B的浓度是原来的60%,则
bB(气)达到平衡后,保持温度不变,将容器体积增大一倍,当达到新平衡时,B的浓度是原来的60%,则
| A.平衡向逆反应方向移动了 |
| B.物质A的转化率减小了 |
| C.物质B的质量分数增加了 |
| D.a>b |