一定条件下,通过下列反应可以制备特种陶瓷的原料MgO,MgSO4(s) + CO(g) MgO(s) + CO2(g) +SO2(g) △H>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s) + CO2(g) +SO2(g) △H>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是

| 选项 |
x |
y |
| A |
温度 |
容器内混合气体的密度 |
| B |
CO的物质的量 |
CO2与CO的物质的量之比 |
| C |
SO2的浓度 |
平衡常数K |
| D |
MgSO4的质量(忽略体积) |
CO的转化率 |
下列离子方程式书写正确的是
| A.Cu(OH)2中加入硫酸:OH-+H+ =H2O |
| B.钠加入水中:Na +2H2O=Na++2OH-+H2↑ |
| C.FeSO4溶液中加入稀硝酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑ |
| D.Al2(SO4)3溶液中加入足量Ba(OH)2溶液:2Al3++3SO42-+ 3Ba2++6OH- =2Al(OH)3↓+3BaSO4↓ |
用如图所示装置进行实验,下列对实验现象的解释不合理的是
| ①中试剂 |
①中现象 |
解释 |
|
| A |
Ba(NO3)2溶液 |
生成白色沉淀 |
SO32-与Ba2+生成白色BaSO3沉淀 |
| B |
品红溶液 |
溶液褪色 |
SO2具有漂白性 |
| C |
紫色石蕊溶液 |
溶液变红 |
SO2与水反应生成酸 |
| D |
酸性KMnO4溶液 |
紫色褪去 |
SO2具有还原性 |
向某无色溶液中分别进行下列操作,所得现象和结论正确的是
| A.加入氨水,产生白色沉淀,证明原溶液中存在Al3+ |
| B.加入AgNO3溶液,产生白色沉淀,证明原溶液中存在Cl- |
| C.加入盐酸酸化的BaCl2溶液,生成白色沉淀,证明原溶液中存在SO42- |
| D.加入NaOH溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体,证明原溶液中存在NH4+ |
依据叙述,写出下列反应的热化学方程式。
(1)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有4NA个电子转移时,放出450 kJ的热量。其热化学方程式为______________________。
(2)已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、395 kJ、940 kJ,则N2与H2反应生成NH3的热化学方程式为____________________________。
(3)钛(Ti)被称为继铁、铝之后的第三金属,已知由金红石(TiO2)制取单质Ti,涉及的步骤为: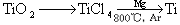
已知:①C(s)+O2(g) 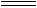 CO2(g); ΔH=-395.5 kJ·mol-1
CO2(g); ΔH=-395.5 kJ·mol-1
②2CO(g)+O2(g) 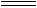 2CO2(g); ΔH=-560 kJ·mol-1
2CO2(g); ΔH=-560 kJ·mol-1
③TiO2(s)+2Cl2(g)+2C(s) 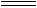 TiCl4(s)+2CO(g)的ΔH=―80kJ/mol
TiCl4(s)+2CO(g)的ΔH=―80kJ/mol
则TiO2(s)与Cl2(g)反应的热化学方程式为。
下列说法或表示方法正确的是
| A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
| B.由C(石墨)=C(金刚石)△H="+1.90" kJ·mol-1可知,金刚石比石墨稳定 |
| C.在稀溶液中,H+(aq))+OH-(aq))=H2O(l)△H=-57.3 kJ·mol-1,若将含0.5 molH2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热大于57.3 kJ |
| D.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2 H2(g)+O2(g)="2" H2O(1)△H=-285.8 kJ·mol-1 |