氰(CN)2,硫氰(SCN)2等称为拟卤素,与卤素单质性质相似,它们的阴离子与也卤素阴离子性质相似,阴离子的还原性顺序为: Cl-<Br-<CN-<SCN-<I-,又知,拟卤素形成的无氧酸和含氧酸一般为弱酸,下列反应中,不合理的是
A.4HCN(浓)+MnO2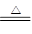 Mn(CN)2+(CN)2↑+2H2O Mn(CN)2+(CN)2↑+2H2O |
| B.(CN)2+H2O=2H++CN-+CNO- |
| C.(CN)2+2OH-=CN-+CNO-+H2O |
| D.(CN)2+2SCN-=2CN-+(SCN)2 |
用下列实验装置能达到实验目的的是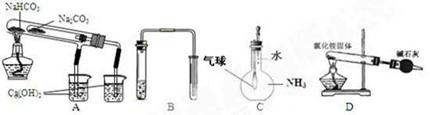
| A.比较NaHCO3和Na2CO3热稳定性大小 |
| B.用铜和稀硝酸制取并收集少量NO |
| C.验证氨气在水中溶解度的大小 |
| D.实验室用氯化铵制少量氨气 |
下列实验过程中,始终无明显现象的是
| A.Cl2通入Na2CO3溶液中 | B.CO2通入CaCl2溶液中 |
| C.NH3通入AgNO3溶液中 | D.SO2通入Ba(NO3)2溶液中 |
同温同压下,在3支体积不同的试管中分别充满等体积混合的2种气体,它们是:①NO和NO2,②NO2和O2,③NH3和N2。现将3支试管均倒置于水槽中,充分反应后,试管中溶质的物质的量浓度分别为c1、c2、c3(假设溶质全在试管中),则下列关系正确的是
| A.c1>c2>c3 | B.c1>c3>c2 |
| C.c1=c3>c2 | D.c1=c2>c3 |
某研究性学习小组做铜与浓硫酸反应实验时,发现试管底部有白色固体并夹杂有少量黑色物质。倒去试管中的浓硫酸,将剩余固体(含少量浓硫酸)倒入盛有少量水的烧杯中,发现所得溶液为蓝色,黑色固体未溶解。过滤、洗涤后,向黑色固体中加入过量浓硝酸,黑色固体溶解,溶液呈蓝色,所得溶液加BaCl2溶液后有白色沉淀生成。下列所得结论正确的是
| A.铜与浓硫酸反应所得白色固体不是CuSO4 |
| B.加BaCl2溶液后所得白色沉淀是BaSO3 |
| C.白色固体中夹杂的少量黑色物质可能是CuO |
| D.白色固体中夹杂的少量黑色物质中一定含有元素Cu和S |
向盐酸中加浓H2SO4时,会有白雾生成,不是导致产生该现象的原因是
| A.浓H2SO4具有脱水性 |
| B.浓H2SO4具有吸水性 |
| C.盐酸具有挥发性 |
| D.气态溶质的溶解度随度随温度的升高而降低 |