某化工厂以软锰矿、闪锌矿(主要成分为MnO2、ZnS,还含有少量的FeS、CuS、Al2O3等物质)为原料制取Zn和MnO2。
(1)在一定条件下,将这两种矿粉在硫酸溶液中相互作用,可得到含有Mn2+、Fe3+、Cu2+、Al3+、Zn2+的酸性溶液,其中发生的主要反应之一如下,请配平此反应方程式:_____MnO2+_____FeS+_____H2SO4=_____MnSO4+_____Fe2(SO4)3+_____S+_____H2O
(2)将所得溶液按以下的工业流程(如图I)进行操作处理得溶液(IV),电解溶液(IV)即得MnO2和Zn.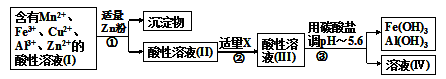 图(Ⅰ)
图(Ⅰ)
a.操作①中加Zn粉后发生反应的离子方程式为_________________;
b.操作②中加入适量X的作用是_________________;
c.工业上用惰性电极电解溶液(IV)获得产品,请写出电解过程中的阳极反应式_________________;
(3)为了从上述流程中产生的Fe(OH)3、Al(OH)3沉淀混合物中回收Al(OH)3,工厂设计了如下的有关流程如图(Ⅱ)。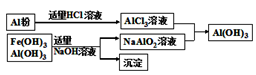 图(Ⅱ)
图(Ⅱ)
a.AlCl3溶液和NaAlO2溶液反应生成Al(OH)3的离子方程式为_________________;
b.若得到n molAl(OH)3,则理论上消耗的NaOH和HCl的物质的量分别为___________、__________;
在一定温度下, 把2molN2和6molH2通入体积不变的容器中。容器中发生以下反应: N2(g) + 3H2(g)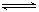 2NH3(g) ,△H= —QKJ/mol。若反应达平衡后, 测得混合气体为7mol。据此回答下列问题:
2NH3(g) ,△H= —QKJ/mol。若反应达平衡后, 测得混合气体为7mol。据此回答下列问题:
保持上述反应温度不变, 设a.b.c分别代表起始加入的N2.H2和NH3的物质的量。如果反应达平衡后混合气体中各物质的百分含量仍与上述平衡时完全相同, 那么:
(1)若a = 1.c =" 2," 则b =。在此情况下, 反应起始时将向方向进行(填“正”或“逆”)。
(2)若需规定起始时反应向逆方向进行,则c的范围是。
已知A为常见金属,X.Y为常见非金属,X.E.F.G常温下为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质)。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图:(注意:其中有些反应的条件及部分生成物被略去)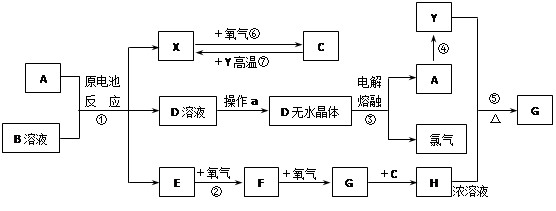
请填写下列空白:
(1)反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为
(2)从D溶液制备D的无水晶体的“操作a”为。
(3)反应②的化学方程式为 。
(4)反应⑤的化学方程式为 。
用酸式滴定管准确移取25.00mL某未知浓度的盐酸溶于一洁净的锥形瓶中,然后用0.20mol·L -1的氢氧化钠溶液(指示剂为酚酞).滴定结果如下:
| NaOH起始读数 |
NaOH终点读数 |
|
| 第一次 |
0.10mL |
18.50mL |
| 第二次 |
0.20mL |
18.80mL |
(1)根据以上数据可以计算出盐酸的物质的量浓度为mol·L-1.
(2)达到滴定终点的标志是
(3)以下操作造成测定结果偏高的原因可能是。
A.配制标准溶液的氢氧化钠中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E.未用标准液润洗碱式滴定管
已知2A(g)+B(g) 2C(g),向容积为1L的密闭容器中加入0.050mol A和0.025mol B,在500℃时充分反应,达平衡后测得
2C(g),向容积为1L的密闭容器中加入0.050mol A和0.025mol B,在500℃时充分反应,达平衡后测得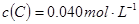 ,放出热量Q1 kJ。
,放出热量Q1 kJ。
(1)能说明上述反应已经达到化学平衡状态的是______________(填字母编号)
a.v(C)=2v(B) b.单位时间内生成2mol A的同时消耗1molB
c.容器内压强保持不变 d.容器内气体的密度保持不变
(2)若在相同的容器中只加入0.050mol C,500℃时充分反应达平衡后,吸收热量Q2 kJ,则Q1与Q2之间的关系式可表示为___________________________(用含Q1、Q2的代数式表示)。
(3)500℃时,上述反应的化学平衡常数K=____________________。
(4)已知K(300℃)>K(350℃),该反应是__________(填“放”或“吸”)热反应;若反应温度升高,A的转化率___________________(填“增大”、“减小”或“不变”)。
(5)某温度下,A的平衡转化率 与体系总压强(P)的关系如图所示,平衡状态由a变到b时,化学平衡常数K(A)______________K(B)(填“>”、“<”或“=”。 )
与体系总压强(P)的关系如图所示,平衡状态由a变到b时,化学平衡常数K(A)______________K(B)(填“>”、“<”或“=”。 )
短周期主族元素A、B、C、D、E、F的原子序数依次增大,它们的原子核外电子层数之和为13。已知B元素形成的化合物种类最多,D元素原子最外层电子数是次外层电子数的3倍,元素E的原子半径在同周期中最大,F元素原子最外层电子数等于其电子层数。
(1)C元素在元素周期表中的位置是_____________________,B的单质与C的最高价氧化物对应水化物的浓溶液发生反应的化学方程式是_____________________________________
(2)由A、B、D、E四种元素形成的化合物中所含的化学键类型是_______________
(3)写出E2D2与A2D反应的离子方程式
_______________________________________________________________________。
(4)实验室配制100mL0.2mol·L—1由A、D、E形成化合物的溶液,需要用到的玻璃仪器除烧杯、小烧杯外还有_________________________;如果定容时仰视刻度线,则所配制溶液浓度_________0.2mol·L—1(埴“>”、“<”或“=”)。将F的单质溶于上述配制的溶液中所发生反应的离子方程式是_________________________