氰(CN)2的化学性质与卤素很相似(X2),称为拟卤素,氰能和氢气反应生成HCN,其水溶液是一种酸。氰的氧化性比溴弱、比碘强。
(1)HCN分子中含有4个共价键,写出HCN的结构式:____________。
(2)KCN溶液显碱性,原因是____________(用离子方程式表示)。
(3)下列有关方程式不正确的是____________。
| A.(CN)2+2NaOH===NaCN+NaCNO+H2O |
| B.MnO2+4HCN===Mn(CN)2+(CN)2+2H2O |
| C.I2+2KCN===2KI+(CN)2 |
| D.向NaBr(aq)和KCN(aq)中加入少量Cl2:Cl2+2NaBr===2NaCl+Br2 |
(4)25℃,0.1mol/LKOH溶液和0.2mol/LHCN溶液等体积混合,若溶液最终PH=8,则c(CN-) c(HCN),原因是 。此溶液中c(CN-)与c(HCN)差值的数值为:
(5)已知HCN可以在氧气中燃烧成CO2、H2O和N2,由此原理可以设计酸性条件下原电池,书写其负极反应式: 。
(共10分)
(1)物质的量浓度相同的①氨水;②氯化铵;⑧碳酸氢铵;④硫酸氢铵;⑤硫酸铵5种溶液中c(NH4+)的大小顺序是______,溶液pH的大小顺序是______。
(2)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其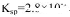 ..CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为
..CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为 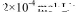 ,则生成沉淀所需CaCl2溶液的最小浓度为。
,则生成沉淀所需CaCl2溶液的最小浓度为。
(3)己知:BaSO4(s)+4C(s)=4CO(g)+BaS(s)△H1=+571.2kJ/mol
BaSO4(s)+2C(s)=4CO2(g)+BaS(s)△H2=+226.2kJ/mol
则反应c(s)+CO2(g)=2CO(g)的△H3=___________kJ/mol。
将一定量的铜粉加入100 mL浓硫酸中,加热发生反应:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O,充分反应后放出13.44 L(标准状况下)气体,固体有剩余,将反应后的溶液加水稀释至500 mL。请按要求回答下列问题:
CuSO4+SO2↑+2H2O,充分反应后放出13.44 L(标准状况下)气体,固体有剩余,将反应后的溶液加水稀释至500 mL。请按要求回答下列问题:
(1)请用双线桥法分析该反应:。
(2)浓硫酸在该反应中的作用是和。
(3)反应后Cu2+的物质的量浓度为多少?(简要写出计算过程)
已知:
(Ⅰ)A是石油裂解气的主要成分,A的产量通常衡量一个国家的石油化工水平。
(Ⅱ)2CH3CHO+O2 2CH3COOH
2CH3COOH
现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
回答下列问题:
(1)写出A的结构式。
(2)B、D所含官能团的名称分别是和。
(3)写出下列反应方程式及反应类型:
①方程式,反应类型。
②方程式,反应类型。
④方程式,反应类型。
某温度时在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:
(1)该反应的化学方程式为:。
(2)反应开始至2min,用Z表示的平均反应速率为:。
(3)下列叙述能说明上述反应达到化学平衡状态的是(填序号)
| A.混合气体的总物质的量不随时间的变化而变化 |
| B.混合气体的压强不随时间的变化而变化 |
| C.单位时间内每消耗3mol X,同时生成2 mol Z |
| D.混合气体的总质量不随时间的变化而变化 |
E.恒定容积,混合气体的密度不再发生改变
(4)在密闭容器里,通入a mol X(g)和b mol Y(g),发生反应X(g)+ Y(g) 2Z(g),当改变下列条件时,反应速率会发生什么变化?(选填“增大”、“减小”或“不变”)
2Z(g),当改变下列条件时,反应速率会发生什么变化?(选填“增大”、“减小”或“不变”)
①升高温度,反应速率;
②保持容器体积不变,充入不参加反应的惰性气体,反应速率。
依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题:
(1)电极X的材料是______;电解质溶液Y是________;
(2)银电极为电池的极,发生的电极反应为;X电极上发生的电极反应为_______反应;(填“氧化”或“还原”)
(3)外电路中的电子(填“流出”或“流向”)Ag电极。
(4)当有1.6 g铜溶解时,银棒增重______ g。