某小组以CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X。为确定其组成,进行如下实验。
①氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1 mL c1 mol·L-1的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2 mol·L-1 NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液。

②氯的测定。
回答下列问题:
(1)装置中安全管的作用原理是______________。
(2)用NaOH标准溶液滴定过剩的HCl时,应使用________式滴定管,可使用的指示剂为________。
(3)样品中氨的质量分数表达式为_________________。
(4)测定氨前应该对装置进行气密性检查,若气密性不好测定结果将_________(填“偏高”或“偏低”)。
(5)氯的测定采用莫尔法,莫尔法是一种沉淀滴定法,用标准硝酸银溶液滴定,进行测定溶液中Cl-的浓度。已知:
| 银盐 性质 |
AgCl |
AgBr |
AgCN |
Ag2CrO4 |
AgSCN |
| 颜色 |
白 |
浅黄 |
白 |
砖红 |
白 |
| 溶解度(mol·L-1) |
1.3410-6 |
7.110-7 |
1.110-8 |
6.510-5 |
1.010-6 |
①若用AgNO3溶液滴定待测液,可选为滴定指示剂的是__________。
A.NaCl B.BaBr2 C.Na2CrO4 D KSCN
②滴定终点的现象是_____________________________________。
I.下图表示从固体混合物中分离Q的2种方案,请回答有关问题。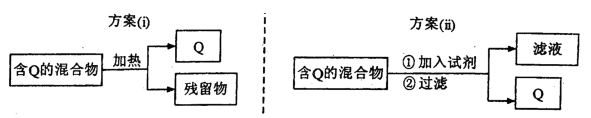
(1)选用方案(i)时,Q应该具有的性质是_____________,残留物应该具
有的性质是__________________________________。
(2)选用方案(ii)从某金属粉末(含有Au、Ag和Cu)中分离Au,加入的试剂为____________。
(3)为提纯某Fe2O3样品(主要杂质有SiO2.Al2O3),参照方案(i)和(ii),请设计一种以框图形式表示的实验方案(注明物质和操作):
______________________________________________________________________________。
Ⅱ.某种含有少量氧化钠的过氧化钠样品(己知样品质量为1.560g、锥形瓶和水的质量为
190.720g),利用右下图所示装置测定混合物中Na2O2的质量分数,每隔相同时间读得电
子天平的数据如下表:
(4)写出Na2O2与H2O反应的化学方程式:________________________________________.
(5)计算Na2O2质量分数时,必需的数据是_________________________________________.
不必作第6次读数的原因是_____________________________________________________.
(6)测定上述样品(1.560g)中Na2O2质量分数的另一种方案,其操作流程如下:
操作②的名称是____________,该方案需直接测定的物理量是_____________ ,测定过程中
需要的仪器有电子天平、蒸发皿、酒精灯,还需要___________、__________(固定、夹
持仪器除外),在转移溶液时,如溶液转移不完全,则Na2O2质量分数的测定结果_______(填
“偏大”、“偏小”或“不变”)。
I、某化学课外活动小组对污染大气的部分非金属氧化物进行探究。请根据题目要求回答下列问题。
(1)写出用硝酸制取NO的离子方程式。
(2)查资料得知,HCOOH CO+H2O。实验室有如图l所示的装置,制取CO气体可选用的装置为
CO+H2O。实验室有如图l所示的装置,制取CO气体可选用的装置为
(填序号),实验室利用该装置还可制取的常见气体有 (写一种气体的分子式)。
(3)查资料得知,利用催化剂可使汽车尾气中的一氧化碳和氮氧化物大部分发生反应转化为二氧化碳和氮气。该小组在实验室模拟汽车尾气处理,设计了如图2所示装置(部分夹持和装置已略去)。

①实验前,关闭旋塞K,先通氮气排净装置中的空气,其目的是。
②装置(III)的主要作用是。
③该套装置中有不完善之处,还应在装置(Ⅳ)后补充装置。
II、该课外小组设计的从ZnSO4、FeCl3的混合溶液中制取ZnSO4·7H2O过程如下:
a.在混合液中加入6 mol/L NaOH溶液,至pH=8为止。
b.过滤后得到沉淀,用蒸馏水多次洗涤沉淀。
c.向洗涤后的沉淀中加入2 mol/L的硫酸,保持溶液的pH在4~6,加热煮沸,趁热过滤,滤液即为ZnSO4溶液。
d.滤液中加入2 mol/L的硫酸,使其pH=2。
已知部分阳离子以氢氧化物的形式开始沉淀至完全沉淀时溶液的pH见下表,回答下列问题:
| 沉淀物 |
Fe(OH)3 |
Zn(OH)2 |
| pH |
1.5~3.2 |
6.4~8.0 |
(1)步骤b中如何检测沉淀已经洗涤干净。
(2)步骤d中加入硫酸,使其pH=2的目的是;要制得ZnSO4·7H2O的步骤d还缺少的操作是,所用的主要硅酸盐仪器是。
氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟制备氨基甲酸铵,并探究其分解反应平衡常数。反应的化学方程式: 2NH3(g)+CO2(g) NH2COONH4(s)。请按要求回答下列问题:
NH2COONH4(s)。请按要求回答下列问题:
(1)请在下图1方框内画出用浓氨水与生石灰制取氨气的装置简图。
(2)制备氨基甲酸铵的装置如下图2所示。生成的氨基甲酸铵小晶体悬浮在四氯化碳中。
①从反应后的混合物中分离出产品的实验方法是_____________(填操作名称)。
②上图3中浓硫酸的作用是_______________________________________。
(3)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积
忽略不计),在恒定温度下使其达到分解平衡。实验测得不同温度下的平衡数据列于下表:
| 温度(℃) |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
| 平衡总压强(kPa) |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
| 平衡气体总浓度(×10-3mol/L) |
2.4 |
3.4 |
4.8 |
6.8 |
9.4 |
①下列选项可以判断该分解反应达到平衡的是________。
A.
B.密闭容器内物质总质量不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②该分解反应的焓变ΔH______0(填“>”、“=”或“<”)。
25.0℃时的分解平衡常数的值=__________________________。
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量将_________(填“增加”,“减少”或“不变”)。
(4)图2中反应器用冰水冷却的原因是_____________________________________。
铁及其化合物在生产和生活中有着广泛的应用。某实验小组设计了如下实验探究
某些含铁化合物的制备、组成、性质等。请按要求回答下列问题:
(1)铁的氯化物的制备与组成:在实验室中,FeCl2可用________和盐酸反应制备,FeCl3可用铁粉和
________反应制备。现有一含有FeCl2和FeCl3的混合物样品,测得n(Fe)∶n(Cl)=1∶2.2,则该样
品中FeCl2和FeC13物质的量之比为__________。
(2)水处理剂和高容量电池材料――高铁酸钾(K2FeO4)的制备与应用:
FeC13与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为
________________________________________________________________________;
与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,其正极电极反应式为
________________________________________________________________________。
(3)光敏材料三草酸合铁酸钾晶体(K3[Fe(C2O4)3]·xH2O)中铁元素含量的测定:
步骤一:称量10.00 g三草酸合铁酸钾晶体,配制成250 mL溶液。
步骤二:取所配溶液25.00 mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳。同时MnO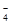 被还原成Mn2+。向反应后的溶液中加入适量锌粉,至黄色刚好消失,所得溶液收集到锥形瓶中,此时溶液仍呈酸性。
被还原成Mn2+。向反应后的溶液中加入适量锌粉,至黄色刚好消失,所得溶液收集到锥形瓶中,此时溶液仍呈酸性。
步骤三:用0.0200 mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02 mL,滴定中MnO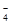 还原成Mn2+。
还原成Mn2+。
重复步骤二、三操作,步骤三消耗0.0200 mol/L KMnO4溶液19.98 mL。
①步骤一中除量筒、玻璃棒、烧杯外,还需要的玻璃仪器有____________________;步骤三滴定过程中盛装KMn4溶液的仪器名称为___________;滴入最后一滴溶液时,锥形瓶中溶液变为_________色,静置半分钟溶液颜色不再变化,确认为滴定终点。
②步骤二加入锌粉的目的是_______________________________;
写出锌参与反应的离子方程式:____________________________________________。
③实验测得该晶体中铁元素的质量分数为____________。在步骤二中,若加入的KMnO4溶液的量不足,则测得的铁元素含量____________。(填“偏低”“偏高”或“无影响”)
四氯化锡常温下是无色液体,在空气中极易水解,熔点-36℃,沸点114℃,金属锡的熔点为231℃。装置A中放浓盐硫,B中放MnO2,二者用于制氯气,用熔融的金属锡跟干燥的氯气直接作用制取无水四氯化锡(此反应过程放出大量的热)。请回答下列各问题。
(1).上图中气体发生和尾气处理装置不够完善,请你提出改进意见_______________________________。
利用改进后的正确装置进行实验,请回答下列问题:
(2)H中反应的离子方程式:_________________________________________________;
E中反应的化学方程式:________________________________________________。
(3)C、D中的试剂分别是_______________、____________________。
(4)仪器A、B的名称分别是_____________、____________,F的作用是_____________。
(5)实验时应先点燃_________处酒精灯,加热温度应大于________ ℃,待________,即可停止加热。
(6)已知四氯化锡遇水强烈水解,产物之一是固态二氧化锡,那么四氯化锡水解的化学方程式为________________________________________________________________。
(7)如果将制取的四氯化锡少许暴露于空气中,预期可看到的现象是___________________________。