工业上利用硫铁矿烧渣(主要成分为Fe3O4、Fe2O3、FeO、SiO2)为原料制备高档颜料--铁红(Fe2O3),具体生产流程如下:
试回答下列问题:
(1)“酸溶”过程中Fe3O4发生反应的离子反应方程式为_________________;
(2)实验室实现“步骤Ⅱ”中分离操作所用的玻璃仪器有_______、玻璃棒和烧杯等;步骤Ⅳ中应选用______试剂调节溶液的pH(填字母编号).
| A.稀硝酸 | B.氢氧化钠溶液 | C.高锰酸钾溶液 | D.氨水 |
(3)检验步骤Ⅲ已经进行完全的试剂是_______;
(4)步骤Ⅴ的反应温度一般需控制在35℃以下,其目的是____________;
(5)步骤Ⅵ中发生反应的化学反应方程式为__________________;
(6)步骤Ⅴ中,FeCO3达到沉淀溶解平衡时,若室温下测得溶液的pH为8.5,c(Fe2+)=1×10-6 mol/L。试判断所得的FeCO3中是否含有Fe(OH)2_____(填“是”或“否”),请通过简单计算说明理由.(已知:Ksp[Fe(OH)2]=4.9×10-17)__________________。
(7)欲测定硫铁矿矿渣中Fe元素的质量分数,称取ag样品,充分“酸溶”、“水溶”后过滤,向滤液中加入足量的H2O2,充分反应后加入NaOH溶液至不再继续产生沉淀,经过滤、洗涤、灼烧至固体恒重,冷却后称得残留固体bg,测得该样品中Fe元素的质量分数为___________。
能源问题是当前世界各国所面临的严重问题,同时全球气候变暖,生态环境问题日益突出,开发氢能、研制燃料电池、发展低碳经济是化学工作者的研究方向。
I.氢气通常用生产水煤气的方法制得。其中CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
△H<0。在850℃时,平衡常数K=1。
(1)若降低温度到750℃时,达到平衡时K1(填“大于”、“小于”或“等于”)
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0molCO、3molH2O、1.0molCO2
和x molH2,则:
①当x=5.0时,上述反应向(填“正反应”或“逆反应”)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是。
③在850℃时,若设x=5.0和x=6.0,其它物质的投料不变,当上述反应达到平衡后,
测得H2的体积分数分别为a%、b%,则ab(填“大于”、“小于”或“等于”)
II.已知4.6g液态乙醇完全燃烧生成二氧化碳和液态水放出热量136kJ·mol液态水转
化为气体水吸收44kJ的热量。
(3)请写出乙醇燃烧生成气态水的热化学方程式
。
(4)将0.1mol乙醇在足量氧气中燃烧,得到的气体全部通入到100mL3mol/LNaOH溶液中,忽略HCO-3的电离,则所得溶液中c(CO2-3)c(HCO-3)(填“大于”、“小于”或“等于”,)原因是(用文字叙述)。
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式 有;
有;
(2)硫酸铜溶液可以加快氢气生成速率的原因是
;
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中
CuSO4溶液起相似作用的是 ;
(4)要加快上述实验中气体产生的速率,还可采取的措施有
;
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体。
记录获得相同体积的气体所需时间。
 实验 实验混合溶液 |
A |
B |
C |
D |
E |
F |
| 4 mol·L-1 H2SO4/mL |
30 |
V1 |
V2 |
V3 |
V4 |
V5 |
| 饱和CuSO4溶液/mL |
0 |
0.5 |
2.5 |
5 |
V6 |
20 |
| H2O/mL |
V7 |
V8 |
V9 |
V10 |
10 |
0 |
①请完成此实验设计,其中:V1=,V6=,V9=;
②反应一段时间后,实验A的金属是呈色,实验E中的金属呈;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因。 .
已知A为一无机盐,C、D、F、N、O为无色气体,E常温常压下为无色无味的液体,N、H、L为高中常见的单质,I为常见无氧强酸,M的焰色反应为紫色,反
应①常用于气体F的检验。
(1)写出G的电子式_______________,M的化学式_____________;
(2)写出反应②的离子反应方程式______________________________;
(3)写出反应③的化学反应方程式_____________;反应①—④中属于非氧化还原反应的是;
(4)用石墨电极电解溶液K时,电解初始阶段电极反应方程式为:
阴极___________________阳极___________________;
(5)已知A在隔绝空气条件下分解产生的各产物的物质的量之比为
B:C:D:E:F=1:2:2:2:2,写出A分解的反应方程式______________。
(10分)葡萄糖是人类的营养素,在体内富氧条件下被氧化生成二氧化碳和水,在缺氧条件下则生成一种有机酸A。将A进行如下图所示的反应。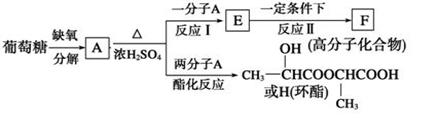
回答下列问题:
(1)写出结构简式:F____________,H________________。
(2)写出下列转化的化学方程式:
E―→F____________________________________________________;
A―→H____________________________________________________。
含有氨基(—NH2)的化合物通常能够与盐酸反应,生成盐酸盐。如:R—NH2+HCl―→R—NH2·HCl(—R代表烷基、苯基等);现有两种化合物A和B,它们互为同分异构体。已知:
①它们都是对位二取代苯;
②它们的相对分子质量都是137;
③A既能被NaOH溶液中和,又可以跟盐酸成盐,但不能与FeCl3溶液发生显色反应;B既不能被NaOH溶液中和,也不能跟盐酸成盐;
④它们的组成元素只能是C、H、O、N、Cl中的几种。
请按要求填空:
(1)A和B的分子式是__________。
(2)A的结构简式是________;B的结构简式是______。