高锰酸钾是中学化学常用的强氧化剂,实验室中可通过以下反应制得:
MnO2熔融氧化:3MnO2+KClO3+6KOH 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
K2MnO4歧化:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
相关物质的溶解度数据见下表:
| 20℃ |
K2CO3 |
KHCO3 |
K2SO4 |
KMnO4 |
| s(g/100g水) |
111 |
33.7 |
11.1 |
6.34 |
已知K2MnO4溶液显绿色,KMnO4溶液紫红色。
实验流程如下:

请回答:
(1)步骤①应在 中熔化,并用铁棒用力搅拌,以防结块。
A.烧杯 B.蒸发皿 C.瓷坩埚 D.铁坩埚
(2)①综合相关物质的化学性质及溶解度,步骤③中可以替代CO2的试剂是 。
A.二氧化硫 B.稀醋酸 C.稀盐酸 D.稀硫酸
②当溶液pH值达10~11时,停止通CO2;若CO2过多,造成的后果是 。
③下列监控K2MnO4歧化完全的方法或操作可行的是 。
A.通过观察溶液颜色变化,若溶液颜色由绿色完全变成紫红色,表明反应已歧化完全
B.取上层清液少许于试管中,继续通入CO2,若无沉淀产生,表明反应已歧化完全
C.用玻璃棒蘸取溶液点在滤纸上,若滤纸上只有紫红色痕迹,无绿色痕迹,表明反应已歧化完全
D.用pH试纸测定溶液的pH值,对照标准比色卡,若pH为10~11,表明反应已歧化完全
(3)步骤④的操作是把滤液移至蒸发皿内,用小火加热,当浓缩至 (填实验现象)时,停止加热,冷却,即有KMnO4晶体析出。
(4)烘干时,温度控制在80℃为宜,理由是 。
(5)通过用草酸滴定KMnO4溶液的方法可测定KMnO4粗品的纯度(质量分数)。
①实验时先将草酸晶体(H2C2O4·2H2O)配成标准溶液,实验室常用的容量瓶的规格有100mL、250mL等多种,现配制90mL 1.5mol·L-1的草酸溶液,需要称取草酸晶体的质量为 g。[已知Mr(H2C2O4·2H2O)=126]
②量取KMnO4溶液应选用 (填“酸式”或“碱式”)滴定管,若该滴定管用蒸馏水洗净后未润洗,则最终测定结果将 (填“偏大”、“偏小”或“不变”)。
下表是元素周期表的一部分,除标出的元素外,表中的每个编号表示一种元素,请根据要求回答下列问题。
| 族 周期 |
ⅠA |
0 |
|||||||
| 1 |
H |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
||
| 2 |
⑤ |
Ne |
|||||||
| 3 |
① |
② |
③ |
④ |
⑥ |
(1)元素④的符号是;
(2)⑤和⑥两种元素原子半径的大小关系:⑤⑥(填“>”或“<”);
(3)①和②两种元素金属性强弱关系:①②(填“>”或“<”);
(4)①的最高价氧化物的水化物与元素③的单质反应的化学方程式为: _ ________ _______。
硫及其部分化合物的转化关系如下图所示。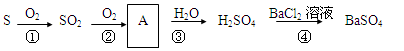
(1)SO2可以使品红溶液褪色,说明SO2具有(填“漂白性”或“氧化性”);
(2)化合物A的化学式为;
(3)反应④的离子方程式为。
(4分)我国已对酒驾实行了“醉驾入刑”,酒的主要成分是乙醇。请回答下列问题:
(1)乙醇的官能团是;
(2)使用K2Cr2O7酸性溶液检测酒驾,利用了乙醇的(填“氧化性”或“还原性”)。
现有以下四种物质:
| A.Si | B.FeCl3 | C.NaHCO3 | D.Na2SiO3 |
请根据题意选择恰当的选项用字母代号填空。
(1)可与KSCN溶液反应,溶液变红的是____;
(2)常用于焙制糕点,也可用作抗酸药的是____;
(3)可用于制备硅胶和木材防火剂的是____;
(4)可用于制造计算机芯片的是。
氯元素是生产生活中常见的非金属元素。
(1)将Cl2通入NaOH溶液中得到以NaClO为有效成分的漂白液,写出该反应的离子方程式:;不直接用Cl2作漂白剂的原因是(写出两条)。
(2)使用Cl2为自来水消毒时,会与水中的有机物生成对人体有害的有机氯化物。下列物质中可以替代Cl2为自来水杀菌消毒的是(填字母序号)。
a.臭氧b.NH3 c.明矾 d.ClO2
(3)生物质混煤燃烧是当今能源燃烧利用的最佳方式之一,但生物质中氯含量较多,燃烧过程中会形成金属氯化物(如NaCl)和Cl2等物质,对金属炉壁造成腐蚀。
①NaCl和Cl2中化学键的类型分别是和。
②燃煤过程中生成的SO2会与NaCl等物质发生反应,生成硫酸盐和Cl2。若生成Cl2 22.4 L(标况)时转移电子数为4×6.02×1023,该反应的化学方程式是。
③已知:
2H2O2(l) ===2H2O(l)+O2(g)ΔH1 =-196.46 kJ·mol-1
H2(g)+ O2(g) ="==" H2O(l)ΔH2 =-285.84 kJ·mol-1
O2(g) ="==" H2O(l)ΔH2 =-285.84 kJ·mol-1
Cl2(g)+H2(g) ="==" 2HCl(g)ΔH3 =-184.60 kJ·mol-1
在催化剂作用下,用H2O2(l)可除去上述燃烧过程中产生的Cl2。依据上述已知反应,写出该反应的热化学方程式:。