【化学—选修5有机化学基础】
物质A(C5H8)是形成天然橡胶的单体,它的一系列反应如下图所示(部分反应条件略去):
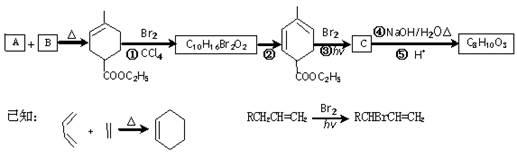
请按要求回答下列问题:
(1)反应①和③的反应类型分别是_____________、_____________。
(2)B的分子式为_________________;B形成高聚物的结构简式为_______________________。
(3)反应②的化学方程式为________________________。
(4)C为一溴代物,分子中含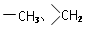 均2个,反应④的化学方程式为_____________________。
均2个,反应④的化学方程式为_____________________。
(5)A的名称是______________________。
写出所有符合下列条件的A的同分异构体的结构简式:____________________
①环状 ②核磁共振氢谱显示有2种氢原子 ③不含立体异构________________________。
用地壳中某主要元素生产的多种产品在现代高科技中占有重要位置,足见化学对现代物质文明的重要作用。例如:
(1)计算机芯片的主要成分是(填化学式,以下同);
(2)光导纤维的主要成分是:
(3)目前应用最多的太阳能电池的光电转化材料是;水玻璃的成分是。
在铝质易拉罐中收集满CO2气体,然后在其中倒入过量浓NaOH溶液,并迅速用胶带将易拉罐口封住,能够观察到的实验现象是易拉罐突然变瘪了,可经过一段时间之后,又可以观察到的现象是。试解释易拉罐变瘪的原因;并解释后一现象的原因。写出反应过程中的两个离子方程式;。
(1)在氧化还原反应中,氧化剂______电子,发生的反应是_________反应;还原剂________电子,发生的反应是____________反应。铁与氯气反应的方程式为_________,生成物中铁是_______价,铁与盐酸的反应式为________,生成物中铁是________价,这一事实证明,氯气的氧化性比盐酸的氧化性(填“强”“弱”)____________。
(2)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药在发生爆炸时,发生如下的反应:2KNO3+C+S===K2S+2NO2↑+CO2↑。其中被还原的元素是(填元素符号),被氧化的元素是(填元素符号),氧化剂是(填化学式,以下同),还原剂是,氧化产物是,还原产物是。
2010年美、日三位科学家因钯(Pd)催化的交叉偶联反应获诺贝尔化学奖。一种钯催化的交叉偶联反应如下: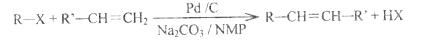
(R、R’为烃基或其他基团)
应用上述反应原理合成防晒霜主要成分K的路线如下图所示(部分反应试剂和条件未注明):
已知:①B能发生银镜反应,1 mol B最多与2 mol H2反应。
②C8H17OH分子中只有一个支链,且为乙基,其连续氧化的产物能与NaHCO3反应生成CO2,其消去产物的分子中只有一个碳原子上没有氢。
③G不能与NaOH溶液反应。
④核磁共振图谱显示J分子有3种不同的氢原子。
请回答:
(1)B中含有的官能团的名称______________。
(2)B→D的反应类型__________________。
(3)D→E的化学方程式_____________。
(4)有机物的结构简式:G________________;K______________。
(5)符合下列条件的同分异构体有(包括顺反异构)______________种,其中一种的结构简式是_______________。
a. 与D互为同系物 b. 相对分子质量是86
(6)分离提纯中间产物E的操作:先用碱除去D和H2SO4,再用水洗涤,弃去水层,最终通过___________操作除去C8H17OH,精制得E。
有机物A常用于食品行业。已知9.0gA在足量O2中充分燃烧,混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,经检验剩余气体为O2。
(1)A分子的质谱图如下图所示,从图中可知其相对分子质量是90,则A的分子式是______________。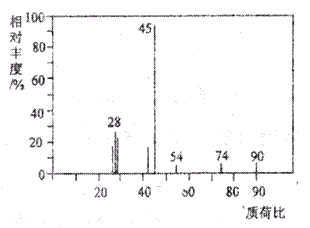

(2)A能与NaHCO3溶液发生反应,A一定含有的官能团名称是_____________。
(3)A分子的核磁共振氢谱有4个锋,峰面积之比是1:1:1:3,则A的结构简式是_______________。
(4)0.1mol A与足量Na反应,在标准状况下产生H2的体积是__________________L。
(5)A在一定条件下可聚合得到一种聚酯,用于制造手术缝合线,其反应的化学方程式是___________________。