浙江大学成功研制出能在数分钟之内将电量充满的锂电池,其成本只有传统锂电池的一半。若电解液为LiAlCl4-SOCl2,电池的总反应为:4Li+2SOCl2 4LiCl+S+SO2。下列说法正确的是:
4LiCl+S+SO2。下列说法正确的是:
| A.充电时阳极反应式为:4Cl-+S+SO2-4e-=2SOCl2 |
| B.电池的电解液可用LiCl水溶液代替 |
| C.放电时电子从负极经电解液流向正极 |
| D.该电池放电时,负极发生还原反应 |
氨分子立体构型是三角锥形,而甲烷是正四面体形,这是因为( )
| A.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化 |
| B.NH3分子中N原子形成3个杂化轨道,CH4分子中C原子形成4个杂化轨道 |
| C.NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强 |
| D.氨分子是极性分子而甲烷是非极性分子 |
下列描述中正确的是( )
| A.CS2为V形的极性分子 |
B.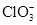 的空间构型为平面三角形 的空间构型为平面三角形 |
| C.SF6中有4对完全相同的成键电子对 |
D.SiF4和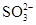 的中心原子均为sp3杂化 的中心原子均为sp3杂化 |
氰气的化学式为(CN)2,结构式为N≡C—C≡N,性质与卤素相似,下列叙述正确的是( )
| A.在一定条件下可发生加成反应 |
| B.分子中N≡C键的键长大于C—C键的键长 |
| C.分子中含有2个σ键和4个π键 |
| D.不和氢氧化钠溶液发生反应 |
根据实际和经验推知,下列叙述不正确的是( )
| A.卤化氢易溶于水,不易溶于四氯化碳 |
| B.碘易溶于汽油,微溶于水 |
| C.氯化钠易溶于水,也易溶于食用油 |
| D.丁烷易溶于煤油,难溶于水 |
氯化硼的熔点为10.7 ℃,沸点为12.5 ℃。在氯化硼分子中,氯—硼—氯键角为120°,它可以水解,水解产物之一是氯化氢。下列对氯化硼的叙述中正确的是( )
| A.氯化硼是原子晶体 |
| B.熔化时,氯化硼能导电 |
| C.氯化硼分子是一种极性分子 |
| D.水解方程式:BCl3+3H2O = H3BO3+3HCl |