草酸镍晶体(NiC2O4 . 2H2O)常用于制镍催化剂。工业上利用镍废渣(主要含镍,还含有Al2O3、Fe、SiO2、CaO等)提取草酸镍晶体的流程如下:

(1)镍废渣粉碎的目的为 。
(2)除铁时,控制不同的条件可以得到不同的滤渣2。已知滤渣2的成分与温度、PH的关系如图所示:

①若控制温度20℃、PH=5,则滤渣2的主要成分为 (填化学式)。
②若控制温度80℃、PH=4,写出该条件下发生反应的离子方程式: 。
(3)滤渣3的主要成分为 (填化学式)。
(4)沉镍时,判断Ni2+是否沉淀完全的方法是 。
(5)硫酸镍(NiSO4)用于化学镀镍时,常用甲醛做还原剂,若氧化产物为CO2,则氧化剂与还原剂的物质的量之比为 。
(6)实验:
I.称量28.7g镀镍试剂,配成100ml溶液;
II.准确量取10.00ml溶液,用0.40mol.l-1的EDTA(Na2H2Y2)标准溶液滴定其中的Ni2+
(离子方程式为Ni2++H2Y2-=NiY2-+2H+),消耗EDTA标准溶液25.00ml;
①配制100ml的镀镍试剂时,需要的仪器除托盘天平、玻璃棒、烧杯、量筒、胶头滴管外,还需要 。
②该镀镍试剂的化学式为 。
简要回答下列问题(并写出问题1、2、4的方程式)
(1)镁燃烧时不能用二氧化碳来扑灭,其原因是。
(2)为什么不能用铜制容器盛氯化铁溶液?。
(3)当人误食重金属盐时,可以喝大量牛奶、蛋清或生豆浆解毒。重金属盐使人中毒的原因是:。
(4)冬季,渔民常在放干水的池塘里遍撒一些漂白粉,其目的是。
对MgCl2、Al2O3、Fe2O3和SiO2组成的混合物进行下列处理,以制取金属Z,并提纯氧化铝。
(1)①和②步骤中分离溶液和沉淀的操作是:
(2)金属Z名称为;残渣A为,固体C是
(3)滤液B的溶质有(填化学式)
(4)写出电解Y 的化学方程式
(5)写出X→B的离子方程式
(6)实验室里常往AlCl3溶液中加入(填“氨水”或“NaOH溶液”)来制取Al(OH)3固体,其反应的离子方程式为
下表为元素周期表的一部分,根据表中所列出的元素回答下列问题
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
C |
N |
O |
F |
||||
| 3 |
Na |
Mg |
Al |
Si |
S |
Cl |
Ar |
(1)最不活泼的元素是(填元素符号,下同),最活泼的非金属元素是
(2)可做半导体材料的元素是(填元素名称)
(3)氧离子结构示意图为,C、N、O原子半径从大到小的顺序是
(4)与水反应最剧烈的金属单质是,其反应的化学方程式是
(5)既能与强酸又能与强碱反应的金属单质是
(6)最高价氧化物的水化物中酸性最强的酸是(写化学式)
(7)气态氢化物的稳定性:H2SHCl(填“>”、“=”或“<”);
(8)Al2O3中铝元素与氧元素的质量比是,氧元素质量分数为
A和B均为钠盐的水溶液,A呈中性,B呈碱性并具有氧化性。下述为相关实验步骤和实验现象: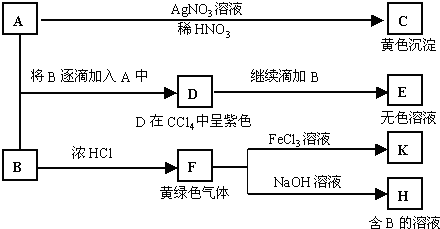
请回答:
(1)写出A和C的化学式:AC 。
(2)依次写出A→D和D→E(E中含有某+5价元素的含氧酸根离子)的离子方程式:
_________________________________、___________________________________。
(3)写出将SO2气体通入K溶液中发生反应的离子方程式:_____________________________。
(4)写出由F→H的化学方程式:__________________________________________。
某反应体系的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
(1)请将Au2O3之外的反应物与生成物分别填入以下空格内。
(2)反应中,被还原的元素是_______,还原剂是____________。
(3)将氧化剂与还原剂填入空格中,并标出电子转移的方向和数目。
(4)纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂物质的量之比为__________。