CO和H2的混合气体俗称合成气,是一种重要的工业原料气,工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气。
CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.1KJ/mol
(1)在一定温度下,向体积为2L的密闭容器中充入0.40mol CH4和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间变化如下表所示:

①计算该反应第一次达平衡时的平衡常数计算式K=_______
②3min时改变的反应条件可能是________(只填一种条件的改变即可)。
(2)已知温度、压强、投料比X[n(CH4)/n(H2O)]对该反应的影响如图所示。

①图1中的两条曲线所示投料比的关系X1____X2(填“=”、“>”或“<”下同)。
②图2中两条曲线所示的压强比的关系:P1____P2。
(3) 以天然气(设杂质不参与反应)、KOH溶液为原料可设计成燃料电池:
①放电时,负极的电极反应式为 _________________
②设装置中盛有的 KOH溶液,在反应后恰好生成KHCO3溶液,则该溶液中各离子浓度由大到小的关系为________________
(共8分)
0.80gCuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。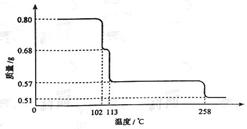
请回答下列问题:
(1)试确定200℃时固体物质的化学式______________(要求写出推断过程)
(2)取270℃所得样品,于570℃灼烧得到的主要产物是黑色粉末和一种氧化性气体,该反应的化学方程式为______________。把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有晶体析出,该晶体的化学式为_________,其存在的最高温度是_____________;
(3)上述氧化性气体与水反应生成一种化合物,该化合物的浓溶液与Cu在加热时发生反应的化学方程式为________________;
(共6分)A、B、C、D是按原子序数由小到大排列的前20号元素的单质。B、E均为组成空气的成分。F的焰色反应呈黄色。在G中,非金属元素与金属元素的原子个数比为1∶2。在一定条件下,各物质之间的相互转化关系如右(部分产物未列出):
(1)A是,C是。
(2)H与盐酸反应生成E的化学方程式是。
(3)E与F反应的化学方程式是
。
(4)F与G的水溶液反应生成I和D的离子方程式是。
(11 分)科学家一直致力研究常温、常压下“人工固氮”的新方法。曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3,反应的化学方程式如下:N2(g)+ 3H2O(l)  2NH3(g)+ O2(g)。回答下列问题:
2NH3(g)+ O2(g)。回答下列问题:
(1)进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2压力1.0×105 Pa、反应时间3 h),则该反应的正反应为反应(填“吸热”或“放热”)
| T/K |
303 |
313 |
323 |
| NH3生成量/(10-6 mol) |
4.8 |
5.9 |
6.0 |
(2)与目前广泛使用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH3生成量的建议: 。
(3)合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。甲烷在高温下与水蒸气反应反应方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g)。部分物质的燃烧热数
据如下:
H2(g) :△H =-285.8 kJ・mol-1;
CO(g) :△H =-283.0 kJ・mol-1;
CH4(g) :△H =-890.3 kJ・mol-1。
已知1mol H2O(g)转变为1mol H2O(l)时放出44.0 kJ热量。写出CH4和H2O在高温下反应的热化学方程式__________________________________。
(4)有人设想寻求适合的催化剂和电极材料,以N2、H2为电极反应物,以HCl——NH4Cl为电解质溶液制成新型燃料电池,请写出该电极的正极反应式
(5)生成的NH3可用于制铵态氮肥,如(NH4)2SO4、NH4Cl,这些肥料显性,原因是(用离子方程式表示)___________________________,使用时避免与________________物质合施。
(14分) 常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 |
HA物质的量浓度(mol/L) |
NaOH物质的量浓度(mol/L) |
混合后溶液的pH |
| 甲 |
0.2 |
0.2 |
pH = a |
| 乙 |
C1 |
0.2 |
pH = 7 |
| 丙 |
0.2 |
0.1 |
pH >8 |
| 丁 |
0.1 |
0.1 |
pH = 9 |
请回答
(1)不考虑其他组的实验结果,单从甲组情况分析,如何用a来说明HA是强酸还是弱酸。
__________________________________________ _____________________________________。
_____________________________________。
(2)不考虑其他组的实验结果,单从乙组情况分析,C1是否一定等于0.2 mol/L________ ,混合后溶液中离子浓度c(A-)和c(Na+)的大小关系是c(A-)_______ c(Na+) (填>、<、=)。
(3)从丙组实验结果分析,HA是_______酸(强、弱),该混合液中的离子浓度由大到小的顺序是______________________________________
(4)丁组混合液中,由水电离的c(H+) =mol·L-1,c (Na+)-c (A-)=mol·L-1;
(5)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH7 (填>、<、= );
(6)将相同温度下相同浓度的四种盐溶液:
A.NH4HCO3 B.NH4A C.(NH4)2SO4 D.NH4Cl
按c(NH4+)由大到小的顺序排列(填序号)
(17分) 重庆有丰富的天然气资源。以天然气为原料合成氨的主要步骤如下图所示(图中某些转化步骤及生成物未列出):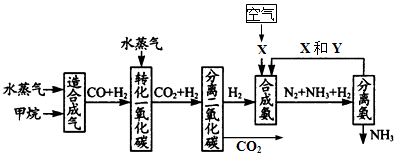
请填写下列空白:
(1)已知2mol甲烷与水蒸气在t℃、p kPa时,完全反应生成一氧化碳和氢气(合成气),吸收了a kJ热量,该反应的热化学方程式是_______________________________。
(2)图中X为_____,Y为_____(填化学式);常用K2CO3溶液吸收分离出的CO2,其离子方程式为_____________________________________
(3)在合成氨工业中,常采取的措施之一是:将生成的氨从混合气体中及时分离出来。请运用化学平衡的观点说明采取该措施的理由:_______________________________。
(4)联合制碱法中,合成氨产生的NH3与CO2通入饱和食盐水最终可制得纯碱,如图所示
①应先向食盐水通足量_______气体(写化学式,后同);副产品Z为______,可用作______;W为_______。
②若生产 Na2CO3 5.3吨,理论上至少可制得副产品Z_______吨。