硼氢化钠(NaBH4)在化工等领域具有重要的应用价值,某研究小组采用偏硼酸钠NaBO2为主要原料制备NaBH4,其流程如下:

已知:NaBH4常温下能与水反应,可溶于异丙酸(沸点:13℃)。
(1)在第①步反应加料之前,需要将反应器加热至100℃以上并通入氩气,该操作的目的是: 。
(2)请配平第①步反应的化学方程式:
NaBO2+ SiO2+ Na+ H2———— NaBH4+ Na2SiO3
(3)第②步操作需要的玻璃仪器有: ;第③步分离出NaBH4并回收溶剂,采用的操作方法是 。
(4)NaBH4与水反应生成NaBO2,且反应前后B的化合价不变,该反应的化学方程式为: ,反应消耗1molNaBH4时转移的电子数目为 。
下表为元素周期表的一部分,针对表中①~⑥元素,回答下列问题
| ① |
② |
||||||||||||||
| ③ |
④ |
⑤ |
⑥ |
(1)②元素在周期表中的位置是第二周期族
(2)写出①的最高价氧化物的电子式
(3)⑤和⑥两种元素的最高价氧化物对应水化物中酸性较强的是(填化学式)
(4)写出④的单质和③的最高价氧化物的水化物反应
(1)写出甲烷发生一氯取代反应的化学方程式
(2)写出苯和浓硝酸、浓硫酸混合液在50 ~ 60℃时发生反应的化学方程式
如右图所示,在试管a中先加3mL乙醇,边摇动边缓缓加入2mL浓硫酸,摇匀冷却后,再加入2ml冰醋酸,充分搅动后,固定在铁架台上。在试管b中加入适量的A溶液。连接好装置,给a加热,当观察到试管b中有明显现象时,停止实验。
(1)右图所示的装置中,装置错误之处是:;
(2)A是溶液;(3)加入浓硫酸的作用是:、;
(4)乙酸跟乙醇在浓硫酸存在并加热和条件下发生的酯化反应(反应A),其逆反应是水解反应(反应B)。反应可能经历了生成中间体(Ⅰ)这一步
如果将反应按加成、消去、取代反应分类,则A—F个反应中(将字母代号填入下列空格中),属于取代反应的是;属于加成反应的是;属于消去反应的是。
请写出下列物质的化学用语:
①葡萄糖的结构简式:
②乙醛与新制氢氧化铜溶液氢氧化钠存在下发生反应的化学方程式为:;
③溴乙烷和氢氧化钠的乙醇溶液共热的反应方程式为:
④石炭酸和足量的氢氧化钠溶液反应化学方程式:
某厂废水中含5.00×10-3mol·L-1的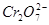 ,其毒性较大。某研究性学习小组为了变
,其毒性较大。某研究性学习小组为了变
废为宝,将废水处理得到磁性材料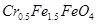 (
(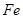 的化合价依次为+3、+2),设计了如下实验流程:
的化合价依次为+3、+2),设计了如下实验流程:


 (1)第①步反应的离子方程式是,
(1)第①步反应的离子方程式是,
(2)第②步中用PH试纸测定溶液PH的操作方法是:
,
(3)第③步过滤得到的滤渣中主要成分除Cr(OH)3外,还有,
(4)欲使1L该废水中的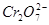 完全转化为
完全转化为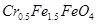 。理论上需要加入
。理论上需要加入
克FeSO4·7H2O。