甲醇可作为燃料电池的原料。工业上利用CO2和H2在一定条件下反应合成甲醇。
(1)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH=-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH=-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
(2)甲醇脱氢可制取甲醛CH3OH(g) HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:

①600K时,Y点甲醇的υ(逆) (正)(填“>”或“<”)
②从Y点到X点可采取的措施是____________________________。
③有同学计算得到在t1K时,该反应的平衡常数为8.1mol·L-1。你认为正确吗?请说明理由 。
(3)纳米级Cu2O由于具有优良的催化性能而受到关注。在相同的密闭容器中,使用不同方法制得的Cu2O(Ⅰ)和(Ⅱ)分别进行催化CH3OH的脱氢实验:CH3OH(g) HCHO(g)+H2(g)
HCHO(g)+H2(g)
CH3OH的浓度(mol·L-1)随时间t (min)变化如下表:
| 序号 |
温度 |
0 |
10 |
20 |
30 |
40 |
50 |
| ① |
T1 |
0.050 |
0.0492 |
0.0486 |
0.0482 |
0.0480 |
0.0480 |
| ② |
T1 |
0.050 |
0.0488 |
0.0484 |
0.0480 |
0.0480 |
0.0480 |
| ③ |
T2 |
0.10 |
0.094 |
0.090 |
0.090 |
0.090 |
0.090 |
可以判断:实验①的前20 min的平均反应速率 ν(H2)= ;实验温度T1 T2(填“>”、“<”);催化剂的催化效率:实验① 实验②(填“>”、“<”)。
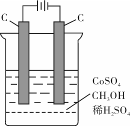
(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用如下图所示装置模拟上述过程, 除去甲醇的离子方程式为 。
常温下,将20 g 14%的NaOH溶液跟30 g 24%的NaOH溶液相混合,得到密度为1.25 g/cm3的混合溶液。计算:
(1)该混合溶液中NaOH的质量分数为 。
(2)该混合溶液的物质的量浓度为 。
(3)在1000g水中需加入g NaOH,才能使其浓度恰好与上述混合溶液的浓度相等。
实验室现只有下列几种规格的容量瓶:100mL、200mL、250mL、500mL。某个实验中需要0.50 mol·L-1NaOH溶液450 mL和0.46 mol·L-1硫酸溶液500 mL,根据相关情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是 (填序号),配制上述溶液还需用到的玻璃仪器是 (填仪器名称)。
(2)用18.4 mol/L的浓硫酸配制0.46 mol·L-1硫酸溶液500 mL的实验中, 步用到胶头滴管。
(3)根据计算用托盘天平称取NaOH的质量为 g。若NaOH固体溶解后立即转移至容量瓶,则所得溶液浓度 0.50 mol·L-1(填“大于”、“等于”或“小于”,下同)。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度 0.50 mol·L-1。
(4)根据计算得知,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为
mL(计算结果保留一位小数)。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是
。
(1)在标准状况下,有下列物质①4gH2,②33.6LCH4, ③1molH2O,④3.01×1023个O2。其
中含分子数最多的是(填序号,下同) ,质量最大的是 ,体积最小的 ;密度由大到小的顺序为 。
(2)实验室从海藻(含碘元素,以碘离子的形式存在)中提取碘的流程如下:
已知2KI+Cl2=2KCl+I2,步骤④的目的是从含碘的有机溶液中分离出单质碘和回收有机溶液。
I.提取碘的过程中有关的实验操作名称:③ 。
II.有下列实验仪器:A.烧杯 B.玻璃棒 C.表面皿 D.分液漏斗 E.酒精灯
步骤①中必须用到的有(填序号) ,还缺少的玻璃仪器有 。
III.提取碘的过程中,选用的萃取剂可以是 。
A.四氯化碳 B.汽油 C.酒精 D.醋酸
(3)写出实验室制取氯气的化学方程式 。
有以下几种物质:
| A.熔融状态的硝酸钾 | B.硫酸(H2SO4) | C.醋酸(CH3COOH) | D.BaSO4固体 |
E、酒精 F、蔗糖 G、葡萄糖 H、干冰 I、铝 J、碳酸钠固体
K、硫酸钠溶液 L、氢氧化钠固体 M、食盐水 N、石墨
在空格中填写正确的序号。
(1)以上物质中能导电的是 ;
(2)以上物质中属于电解质的是 ;
(3)以上物质中属于非电解质的是 。
将28 g KOH固体溶于172 g水中形成溶液A。
(1)溶液A的质量分数为 ;
(2)若将该溶液蒸发掉100 g水后形成溶液B,体积为80 mL。则溶液B的物质的量浓度为
mol·L—1。