“探险队员”——盐酸,不小心走进了化学迷宫,迷宫有许多“吃人的野兽”(即能与盐酸反应的物质),盐酸必须避开它们,否则就无法通过。

(1)请你帮助它走出迷宫(请用图中物质前的序号连接起来表示所走的路线)_____________。
(2)在不能“吃掉”盐酸的物质中,属于非电解质的是________(填写物质序号),在能“吃掉”盐酸的物质中,属于电解质的是 (填写物质序号)。
(3)如果将盐酸换成碳酸镁,它能沿着盐酸走出的路线“走出”这个迷宫吗?填“能”或“不能”_____,写出离子方程式说明其原因: 。
(4)写出氧化铝与④反应的化学方程式 ,氧化铝属于 ____________氧化物(填“酸性”“碱性”或“两性”)。
聚四氟乙烯的耐热性和化学稳定性都超过了其他合成材料,号称“塑料王”。在工业生产上有广泛的应用,其合成路线如下: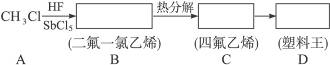
试完成下列各题:
(1)在直方框内填写有机物的结构简式。
(2)写出下列反应的化学方程式:
B→C:__________________________________________________________________;
C→D:__________________________________________________________________。
某一溴代烷A与氢氧化钠溶液混合后充分振荡,生成有机物B;A在氢氧化钠和B的混合液中共热生成一种气体C;C可由B与浓H2SO4混合加热制得,C可作果实催熟剂。则:
(1)A的结构简式为:______________________。
(2)A生成B的化学方程式:______________________。
(3)A生成C的化学方程式:______________________。
(4)B生成C的反应类型:______________________。
在NaCl溶液中滴入AgNO3溶液,现象为_____________________,离子方程式为_____________________。在CH3CH2Cl中滴加AgNO3溶液,现象为______________________,原因是______________________。若将CH3CH2Cl跟NaOH溶液共热,然后用稀HNO3酸化,再滴入AgNO3溶液,现象为______________,反应的化学方程式为______________________。
下列物质中:
 ⑤NaHSO3溶液
⑤NaHSO3溶液
(1)能与NaOH溶液发生反应的是____________。
(2)能与溴水发生反应的是___________。
(3)能与金属钠发生反应的是___________。
A、B、C、D四种芳香族化合物的结构简式如下所示: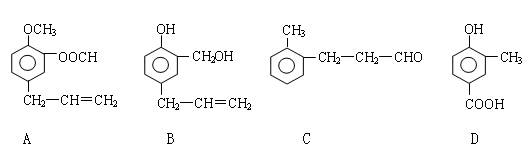
请回答下列问题:
(1)写出A中无氧官能团的名称 ;D中含氧官能团的结构简式为 。
(2)用A、B、C、D填空:能发生银镜反应的有 ;既能与FeCl3溶液发生显色反应又能与Na2CO3溶液反应放出气体的是 。
(3)按下图C经一步反应可生成E,E是B的同分异构体,
则反应①的反应类型为 ;写出反应②的化学方程式: 。
(4)G、H和D互为同分异构体,它们具有如下特点:
① G和H都是苯的二元取代物,这两个取代基分别为羟基和含有-COO-结构的基团;
② G和H苯环上的一氯代物有两种不同结构;
③ G可以发生银镜反应,H分子中苯环不与取代基碳原子直接相连 。
写出G和H的结构简式:G: ;H: 。