TMB是一种新型指纹检测的色原试剂,由碳、氢、氮三种元素组成,与氢气的相对分子质量之比为120。某研究性学习小组的同学欲利用下列仪器测定TMB的分子式。其主要过程为在足量氧气流中将4.80 g TMB样品氧化(氮元素转化为N2),再利用吸收剂分别吸收水蒸气和CO2。请从图中选择适当的装置(装置符合气密性要求,加热装置等已略去,其他用品可自选)。

(1)写出C中的化学反应方程式:_________________
(2)B 中试剂是 ,作用是________________________
(3)实验后称得A及以后的装置(均用A装置并假设每次吸收均是完全的)质量依次
增加3.60 g、14.08 g、0.14 g,则TMB的分子式为__________________________。
(4)除A外还需重复使用D装置,该装置内药品是 ,如果缺少该装置将引起 元素的计算值 (填“偏高”,“偏低”,“无影响”)
(5)该实验 (填“需要”、“不需要”)尾气处理,请写明理由____________
(16分)为探究苯与溴的取代反应,甲用如图装置Ⅰ进行如下实验:
将一定量的苯和溴放在烧瓶中,同时加入少量铁屑,3~5 min后发现滴有AgNO3的锥形瓶中有浅黄色的沉淀生成,即证明苯与溴发生了取代反应.
(1)装置I中①的化学方程式为________________________________________,
_________________________________________.
②中离子方程式为__________________________________________________.
(2)①中长导管的作用是________________________________________________.
(3)烧瓶中生成的红褐色油状液滴的成分是__________________________,要想得到纯净的产物,可用_____________________试剂洗涤.洗涤后分离粗产品应使用的仪器是____________________.
(4)乙同学设计如图所示装置Ⅱ,并用下列某些试剂完成该实验.可选用的试剂是:苯;液溴;浓硫酸;氢氧化钠溶液;硝酸银溶液;四氯化碳.
a的作用是__________________________________________________________.
b中的试剂是__________________________________________________________.
比较两套装置,装置Ⅱ的主要优点是_______________________________.
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线: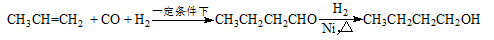
其中CO的制备原理:HCOOH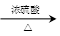 CO↑+H2O,并设计出原料气的制备装置(如下图)
CO↑+H2O,并设计出原料气的制备装置(如下图)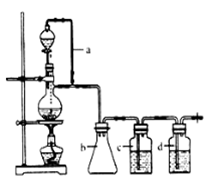
请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2-丙醇,从中可以选择合适的试剂制备氢气、丙烯。写出制备丙烯的化学方程式:。
(2)若用以上装置制备干燥纯净的CO,装置中a的作用是,装置中b的作用是,c中盛装的试剂是。
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是(填序号)
①饱和Na2SO3溶液②酸性KMnO4溶液③石灰水④无水CuSO4⑤品红溶液
(4)正丁醛经催化加氢得到含少量正丁醛的1-丁醇粗品,为纯化1-丁醇,该小组查阅文献得知:
①R—CHO+NaHSO3(饱和) RCH(OH)SO3Na↓;②沸点:乙醚34℃,1-丁醇118℃,并设计出如下提纯路线:
RCH(OH)SO3Na↓;②沸点:乙醚34℃,1-丁醇118℃,并设计出如下提纯路线:
试剂1为,操作2为,操作3为。
(15分)实验室用氢氧化钠固体配制1.0 mol/L的NaOH溶液500 mL,回答下列问题:
(1)请简要叙述该实验的主要实验步骤:
①__________________;②__________________;
③__________________;④__________________;
⑤__________________;⑥__________________。
(2)所需仪器为:容量瓶(规格为________)、托盘天平,还需要哪些实验仪器才能完成该实验,请写出:_________________________________________
(3)下列操作对所配溶液的浓度有何影响?(填写字母)
偏大的有_______________;偏小的有;无影响的有。
| A.称量时使用了生锈的砝码 |
| B.将NaOH放在纸张上称量 |
| C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中 |
| D.往容量瓶中移液时,有少量液体溅出 |
E.未洗涤溶解NaOH的烧杯
F.定容时仰视刻度线
G.容量瓶未干燥即用来配制溶液
H.定容后盖上瓶塞反复摇匀,静置后,发现液面不到刻度线,再加水至刻度线
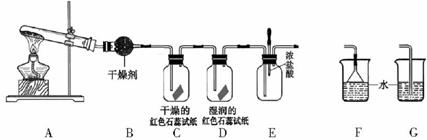
某中学化学研究性学习小组利用以下装置制取并探究氨气的性质。A中发生反应的化学方程式: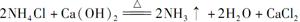
【实验探究】
(1)A中的反应(填“是”或“不是”)氧化还原反应。
(2)A装置还可用于制取气体(只填一种)
(3)若有10.7gNH4Cl固体,最多可制取NH3(标准状况)的体积是L (NH4C1的摩尔质量为53.5g·mol-1)。
(4)实验室收集氨气的方法是
(5)C、D装置中颜色会发生变化的是(填“C”或“D”)
(6)当实验进行一段时间后,挤压E装置中的胶头滴管,滴人1-2滴浓盐酸,可观察到的现象是
(7)为防止过量氨气造成空气污染,需要在上述装置的末端增加一个尾气处理装置,合适的装置是(填“F”或“G”)。
【知识拓展】
(8)生石灰与水反应生成Ca(OH)2并放出热量[化学方程式为CaO+H2O==Ca(OH)2]。实验室利用此原理,往生石灰中滴加浓氨水,可以快速制取氨气。你认为生石灰可用下列物质代替(填序号)。
A.碱石灰(NaOH与CaO的固体混合物) B.NaOH 固体
C.硫酸溶液 D.石灰石(含CaCO3)
【知识应用】
(9)2010年11月9日晚,我省宁德市一冷冻厂发生氨气泄漏事件,500 多居民深夜大转移。假如你在现场,你会采用什么自救为法?
某中学研究性学习小组为探究碳酸钠和碳酸氢钠两种物质的性质、制法和用途,进行了如下实验:
实验一、如图Ⅰ~Ⅳ所示。
(1)若用实验Ⅳ来验证碳酸钠和碳酸氢钠的热稳定性,则试管B中装入的固体最好是,能说明碳酸钠比碳酸氢钠稳定的实验现象是。
(2)若用实验来鉴别碳酸钠和碳酸氢钠两种固体,能达到实验目的的是(填装置序号)。其中能够说明泡沫灭火器中选择碳酸氢钠与酸反应制CO2而不选择碳酸钠的实验是。
(3)若测定Na2CO3固体中混有的少量NaHCO3的质量分数,采用实验Ⅲ能否达到实验目的?若能,请说明其计算所需的数据;若不能,请简要说明理由。
实验二、将碳酸氢钠溶液与澄清石灰水混合并充分反应。
(4)当石灰水过量时,反应的离子方程式为。
(5)当碳酸氢钠与氢氧化钙物质的量之比为2:1时,所得溶液中溶质的化学式为。
实验三、(6)检验“侯氏制碱法”制得的纯碱中是否混有食盐所需的试剂是;