【选修2:化学与技术】锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌。某含锌矿的主要成分为ZnS(还含少量FeS等其他成分),以其为原料冶炼锌的工艺流程如图所示:
回答下列问题:
(1)硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的主要成分的化学式为___________。
(2)焙烧过程中产生的含尘烟气可净化制酸,该酸可用于后续的____________________操作。
(3)浸出液“净化”过程中加入的主要物质为___________ ,其作用是__________________。
(4)电解沉积过程中的阴极采用铝板,阳极采用Pb-Ag合金惰性电极,阳极逸出的气体是________。
(5)改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。“氧压酸浸”中发生的主要反应的离子方程式为___________。
同量Al2(SO4)3分别与适量下列溶液反应,可能生成沉淀的物质的量最大的是_______,沉淀质量最大的是________。
| A.NH3·H2O | B.NaAlO2 | C.NaOH | D.Ba(OH)2 |
有一透明溶液,可能含有Al3+、Fe3+、K+、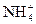 、Mg2+和Cu2+等离子中的一种或几种。现加入Na2O2粉末只有无色无味的气体放出,并同时析出白色沉淀。如加入Na2O2的量与生成白色沉淀的量之间的关系用右图来表示。试推断:
、Mg2+和Cu2+等离子中的一种或几种。现加入Na2O2粉末只有无色无味的气体放出,并同时析出白色沉淀。如加入Na2O2的量与生成白色沉淀的量之间的关系用右图来表示。试推断:
(1)原溶液中一定含有___________离子。
(2)一定不含有___________离子。
(3)可能含有___________离子。
(4)为了进一步确定可能含有的离子,应增加的实验操作为___________。
某无色透明溶液A,是由H+、Ba2+、Mg2+、OH-、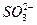 、
、 、
、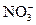 、Cl-中的若干离子组合而成的,它能与铝作用只放出H2,试分为酸性、碱性两种情况讨论其组成。
、Cl-中的若干离子组合而成的,它能与铝作用只放出H2,试分为酸性、碱性两种情况讨论其组成。
(1)若A溶液呈明显的酸性,则除H+外,溶液中还可能有显著量的_________、_________、_________离子。
(2)若A溶液呈明显的碱性,则除OH-外,溶液中还可能有显著量的_________、_________、_________离子。
某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的转化: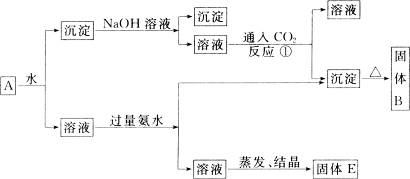
据此判断:
(1)固体B所含物质的化学式为_______________________________。
(2)固体E所含物质的化学式为_______________________________。
(3)反应①的离子方程式为____________________________________。
取一根镁条置于坩埚内点燃,得到氧化镁和氮化镁的混合物的总质量为0.470 g,冷却后加入足量水,再将溶液蒸干并灼烧得到氧化镁0.486 g,按要求完成下列问题:
(1)氮化镁的电子式____________________________。
(2)混合物中加入水的反应方程式____________________________。
(3)燃烧产物中氧化镁的质量分数____________________________。
(4)镁燃烧生成氧化镁和氮化镁时,共转移电子____________________________mol。