在密闭容器中充入一定量的NO2,发生反应2NO2(g) N2O4(g)
N2O4(g) 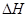 =-57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如下图所示。下列说法正确的是
=-57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如下图所示。下列说法正确的是

| A.a、c两点的反应速率:a>c |
| B.a、b两点NO2的转化率:a<b |
| C.a、c两点气体的颜色:a深,c浅 |
| D.由a点到b点,可以用加热的方法 |
与当今地球上重大环境问题不相关的物质是()
| A.CO2 | B.N2 | C.SO2 | D.CC12F2 |
在10mL0.1mol·L-1NaOH溶液中加入同体积、同浓度的CH3COOH溶液,反应后溶液中各微粒的浓度关系错误的是
| A.C(Na+)>C(CH3COO-)>C(H+)>C(OH-) |
| B.C(Na+)>C(CH3COO-)>C(OH-)>C(H+) |
| C.C(Na+)> C(CH3COO-)>C(CH3COOH) |
| D.C(Na+)+C(H+)=C(CH3COO-)+C(OH-) |
为更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG= ,则下列叙述正确的是( )
,则下列叙述正确的是( )
| A.中性溶液的AG=7 |
| B.酸性溶液的AG<0 |
| C.常温下0.lmol/L氢氧化钠溶液的AG=12 |
| D.常温下0.lmol/L盐酸溶液的AG=12 |
将0.2mol·L-1HCN溶液和0.1mol·L-1的NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的是()
| A.c(HCN)<c(CN-) | B.c(Na+)<c(CN-) |
| C.c(HCN)-c(CN-)=c(OH-) | D.c(HCN)+c(CN-)=0.1mol·L-1 |
同温同压下两个等体积的干燥烧瓶中分别充满①NH3 、②NO2,进行喷泉实验,经充分反应后烧瓶内溶液的物质的量浓度为()
A①<② B①>② C①=② D无法确定