铜及其化合物在工农业生产及日常生活中应用非常广泛。某研究小组用粗铜(含杂质铁)制备氯化铜晶体(CuCl2·2H2O)的流程如下:

已知常温下,Cu2+、Fe3+的氢氧化物开始沉淀和沉淀完全时的pH见下表:
| 金属离子 |
Fe3+ |
Cu2+ |
| 氢氧化物开始沉淀时的pH |
1.9 |
4.7 |
| 氢氧化物完全沉淀时的pH |
3.2 |
6.7 |
请回答下列问题:
(1)溶液Ⅰ中加入试剂X可以调节溶液pH,从而除去Fe3+且不引人杂质
①试剂X选用下列物质中的_______(填代号)。
a.NaOH b.CuO c.Cu d.Cu(OH)2
②调节溶液pH时,理论上可选择pH最大范围是____________________________。
(2)检验溶液Ⅰ中的存在Fe3+实验操作是_____________________。
(3)向溶液Ⅱ中通入H2S气体,溶液变浑浊,pH减小,用离子方程式解释其原因________________;
(4)某学习小组用碘量法测定CuCl2•2H2O样品的纯度(杂质不参与反应),实验如下:
a.准确称取CuCl2•2H2O样品mg于小烧杯中,加入适量蒸馏水和足量的碘化钾,再滴入适量的稀硫酸,充分反应后,将所得混合液配成250mL待测溶液.(已知:2Cu2++4I-═2Cu↓+I2)
b.移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用cmol•L-1Na2S2O3标准液滴定至终点,重复2次,测得消耗标准液体积的平均值为VmL.(已知:I2+2S2O32-═2I-+S4O62-)
①实验中使用的指示剂名称为___________;
②达到滴定终点时,仰视滴定管读数将使测定结果__________(填“偏高”“偏低”或“无影响”)
③该样品中的质量分数为__________(用含m,c,V的代数式表示,不用化简)。
(5)在空气中由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是________________。
在下列各组物质中,找出合适的序号填在对应的空格内:
①NO2和N2O4 ②12C和14C ③ 和
和 
④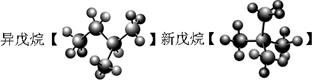

⑥甲烷与丙烷 ⑦乙醇(CH3CH2OH)和乙二醇(HO—CH2—CH2—OH)
注意:以上七组物质,不一定是每组物质都能找到对应填空
⑴互为同位素的是 ;⑵互为同分异构体的是 ;
⑶互为同系物的是 ;⑷同一种物质的是 。
有下列物质:①Cl2 ②Na2O2 ③NaOH ④HCl ⑤H2O2 ⑥MgF2 ⑦NH4Cl
(1)只由离子键构成的物质是________
(2)只由极性键构成的物质是________
(3)只由非极性键构成的物质是____
(4)只由非金属元素组成的离子化合物是____
(5)由极性键和非极性键构成的物质是____ _
(6)由离子键和极性键构成的物质是___、 _
(7)由离子键和非极性键构成的物质是__ _
过渡金属催化的新型碳—碳偶联反应是近年来有机合成的研究热点之一,如:
反应①
化合物Ⅱ可由化合物合成: 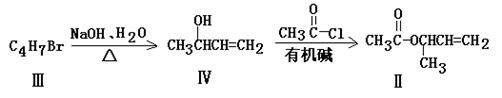
(1)化合物Ⅰ的分子式;化合物Ⅱ的官能团名称是;
(2)化合物Ⅱ与Br2加成的产物的结构简式为
(3)化合物Ⅲ的结构简式为
(4)在浓硫酸存在和加热条件下,化合物Ⅳ易发生消去反应生成不含甲基的产物,该反应的方程式为
(注明反应条件),
因此,在碱性条件下,由Ⅳ与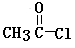 反应生成Ⅱ,其反应类型为。
反应生成Ⅱ,其反应类型为。
(5)Ⅳ的一种同分异构体Ⅴ能发生银镜反应,Ⅴ与Ⅱ也可以发生类似反应①的反应,生成化合物Ⅵ,Ⅵ的结构简式为(写出其中一种)。
已知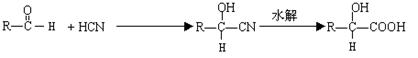
分析下图变化,试回答下列问题: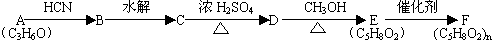
(1)写出有机物的结构简式
AC DE
(2)写出下列有关反应的化学方程式并注明有机反应类型:
D →E;
E →F ;
已知某有机物相对分子质量为58,根据下列条件,回答:
(1)若该有机物只含碳、氢两种元素,则可能的结构简式为________________;
(2)若为含氧衍生物,且分子中只有一个—CH3,则可能的结构简式为________;